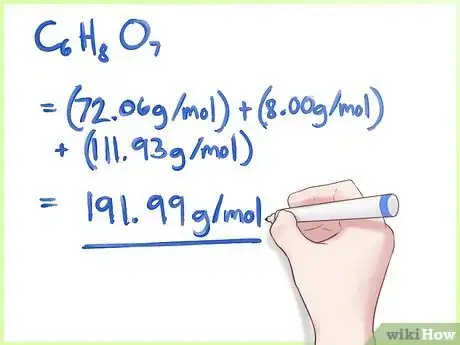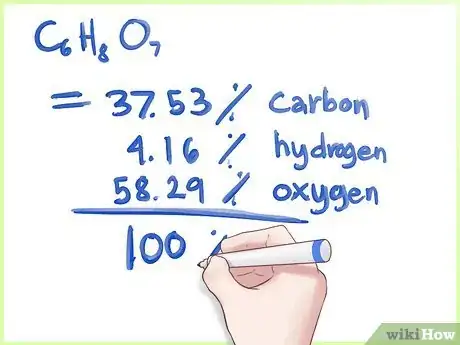wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, des auteur.e.s volontaires ont participé à l'édition et à l'amélioration.
Cet article a été consulté 10 881 fois.
La décomposition du pourcentage massique d'une molécule donne la part que prend la masse de chacun des éléments constitutifs dans la masse totale de la molécule en question. Le pourcentage massique de chaque élément d'un composé (par rapport à la masse totale de la molécule) s'exprime sous la forme d'un ratio ou d'un pourcentage si l'on multiplie le ratio par 100. Cela peut paraitre compliqué au premier abord, mais finalement c'est assez simple.
Étapes
Méthode 1
Méthode 1 sur 2:Comprendre quelques éléments fondamentaux
-
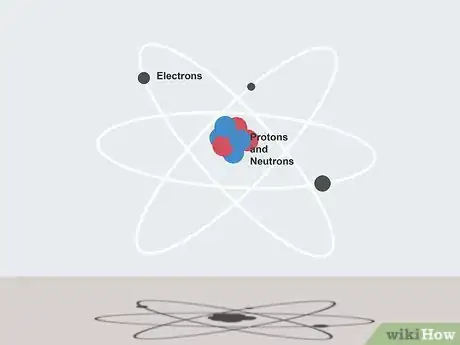
1Comprenez bien ce que sont les atomes. Ce sont les « briques » de base de la matière. Ils sont composés de protons et de neutrons (dans le noyau) et d'électrons (autour du noyau). Ce sont les éléments constitutifs de tout ce qui nous environne, vivant ou non.
-
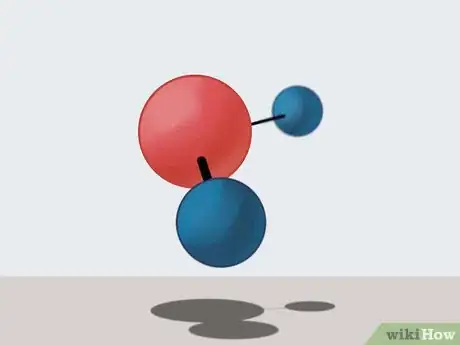
2Comprenez bien ce que sont les molécules. Ce sont des groupements d'atomes (deux ou plusieurs) électriquement neutres. Ces atomes ont entre eux des liaisons dites électroniques.
- L'eau est constituée de molécules H2O. Chacune est composée de 2 atomes d'hydrogène et d'un d'oxygène.
-
3Comprenez bien ce que sont les moles. La mole est une unité de mesure de la quantité de matière contenue dans un système. La molécule est une unité trop petite pour faire des calculs. On a alors inventé la mole qui est une quantité de matière contenant 6,02 x 1023 entités élémentaires. Les quantités de matière s'expriment toujours en moles.
- Le nombre d'Avogadro, 6,02 x 1023, correspond au nombre d'atomes de carbone dans 12 grammes de l'isotope 12 du carbone.
-
4Comprenez ce qu'est un composé chimique. C'est une substance chimique composée de deux ou plusieurs éléments chimiques.
- Par exemple, l'eau (de formule H2O) est un composé chimique.
-
5Comprenez bien ce qu'est la masse atomique. C'est la masse totale des protons et des neutrons dans un atome unique à l'état de repos (par convention, on néglige la masse des électrons). Elle s'exprime en grammes par mole (g/mol).
- La masse atomique est différente du poids atomique. La masse fait référence aux propriétés du corps, tandis que le poids est fonction de la gravité du lieu.
-
6Comprenez bien ce qu'est la masse moléculaire. C'est la masse d'une seule molécule. Dit autrement, cette masse est la somme de toutes les masses des atomes qui composent ladite molécule.
- Comme précédemment, la masse moléculaire n'est pas le poids moléculaire.
Publicité
Méthode 2
Méthode 2 sur 2:Calculer le pourcentage massique
-
1Dressez la liste des éléments de votre composé.
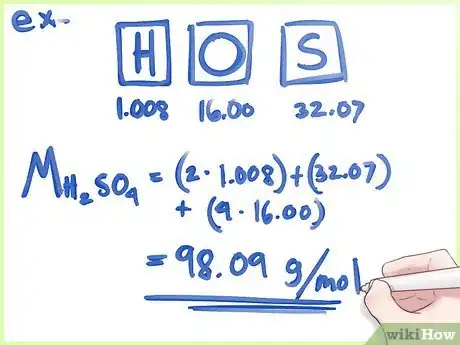
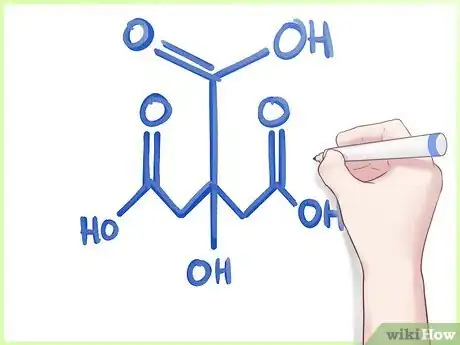
- À titre d'exemple, nous allons calculer le pourcentage massique de l'acide citrique, C6H8O7, qu'on peut voir sur l'image. Cet acide est composé de carbone (C), d'hydrogène (H) et d'oxygène (O).
-
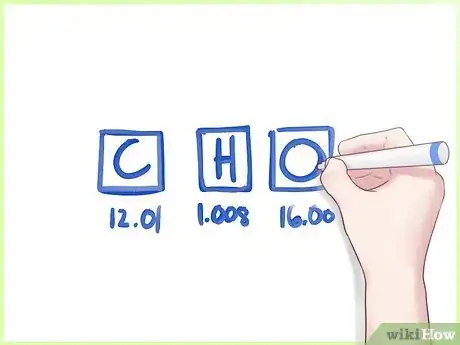
2Inscrivez la masse atomique de chacun de ces éléments. Utilisez pour cela la table périodique. Le chiffre est inscrit juste en dessous du symbole de l'élément. Il vous donne la valeur en g/mol.
- Ainsi, pour reprendre notre exemple, la masse atomique du carbone est de 12,01 g/mol, celle de l'hydrogène est de 1,00 g/mol et celle de l'oxygène est de 15,99 g/mol.
-
3Trouvez la part de la masse de chaque élément dans la masse totale du composé. Cette masse est fonction de la masse atomique de l'élément multiplié par le nombre d'atomes entrant dans la molécule en question. Le chiffre inscrit après chaque symbole indique le nombre d'atomes de cet élément dans la molécule : H2 signifie deux atomes d'hydrogène.
- Reprenons l'exemple précédent. Chaque molécule de notre composé est construite avec 6 atomes de carbone, 8 d'hydrogène et 7 d'oxygène. Il faut maintenant calculer la masse de chaque élément dans la masse totale de la molécule.
Masse du carbone : 6 x 12,01 g/mol = 72,06 g/mol
Masse de l'hydrogène : 8 x 1,00 g/mol = 8.00 g/mol
Masse de l'oxygène : 7 x 15,99 g/mol = 111,93 g/mol
- Reprenons l'exemple précédent. Chaque molécule de notre composé est construite avec 6 atomes de carbone, 8 d'hydrogène et 7 d'oxygène. Il faut maintenant calculer la masse de chaque élément dans la masse totale de la molécule.
-
4Calculez la masse moléculaire totale du composé. C'est la somme des masses de chacun des éléments constitutifs du composé. C'est la masse d'une seule molécule, d'où le nom de masse moléculaire.
- Avec notre exemple, le calcul de la masse moléculaire s'établit comme suit :
Masse moléculaire de C6H8O7 = 72,06 g/mol + 8.00 g/mol + 111,93 g/mol = 191,99 g/mol
- Avec notre exemple, le calcul de la masse moléculaire s'établit comme suit :
-
5Trouvez le pourcentage massique de chaque élément. On a la masse moléculaire totale, on a la masse de chaque élément, on peut trouver le pourcentage massique en divisant la masse de l'élément par la masse totale et en multipliant par 100 pour obtenir un pourcentage.
- Avec notre exemple, calculez le pourcentage de chaque élément indiqué sur l'image. Vous pouvez alors conclure que la molécule de C6H8O7 est composée à 37,53 % de carbone, à 4,16 % d'hydrogène et 58,29 % d'oxygène.
Publicité
Conseils
- Vous pouvez vérifier vos calculs en additionnant tous vos pourcentages. Vous devez obtenir 100 %. Enfin, presque ! Votre résultat sera toujours inférieur, car les masses atomiques sont toujours arrondies à deux chiffres après la virgule.
Références
- http://chemistry.about.com/od/workedchemistryproblems/a/How-To-Calculate-Mass-Percent.htm
- http://en.wikipedia.org/wiki/Atom
- http://chemistry.about.com/od/moleculescompounds/f/What-Is-A-Molecule.htm
- http://chemistry.about.com/cs/generalchemistry/f/blmole.htm
- http://www.universetoday.com/73476/what-is-atomic-mass/
- http://www.princeton.edu/~achaney/tmve/wiki100k/docs/Molecular_mass.html