استشراب السائل رفيع الإنجاز
الاستِشراب السَّائِل الرَّفيع الإنجَاز[1] هي تقنية في الكيمياء التحليلية تُستخدم لفصل وتحديد وقياس كل مكون في خليط. يعتمد على المضخات لتمرير مذيب سائل مضغوط يحتوي على خليط العينة من خلال عمود مملوء بمادة ممتصة صلبة. يتفاعل كل مكون في العينة بشكل مختلف قليلاً مع المادة الممتزة، مما يتسبب في معدلات تدفق مختلفة للمكونات المختلفة ويؤدي إلى فصل المكونات أثناء تدفقها خارج العمود. يجري استخدام تقنية HPLC في الصناعة (على سبيل المثال، أثناء عملية إنتاج المنتجات الصيدلانية والبيولوجية)، وفي مجال القانوني والرياضي والجنائي (على سبيل المثال، الكشف عن عقاقير تحسين الأداء في البول)، في مجال البحثي (على سبيل المثال، فصل مكونات عينة بيولوجية معقدة، أو مواد كيميائية اصطناعية مماثلة similar synthetic chemicals من بعضهما البعض)، وفي المجال الطبي (على سبيل المثال، الكشف عن مستويات فيتامين د vitamin D في مصل الدم).[2] يمكن وصف الكروماتوغرافيا بأنها عملية انتقال مادة mass transfer process تتضمن الامتزاز adsorption. تعتمد تقانة HPLC على المضخات لتمرير سائل مضغوط وخليط عينة عبر عمود مملوء بمادة ماصة adsorbent، مما يؤدي إلى فصل مكونات العينة. المكون النشط للعمود، الممتزات adsorbent، عادة ما يكون عبارة عن مادة حبيبية مصنوعة من جزيئات صلبة (مثل السيليكا والبوليمرات وما إلى ذلك)، بحجم 2-50 ميكرومتر. يتم فصل مكونات مزيج العينة عن بعضها بسبب اختلاف درجات تفاعلها مع جزيئات الامتصاص. السائل المضغوط عادة عبارة عن خليط من المذيبات (على سبيل المثال، ماء، أسيتونيتريل و/أو ميثانول) ويشار إليه باسم «الطور المتحرك» mobile phase. يلعب تكوينه ودرجة حرارته دورًا رئيسيًا في عملية الفصل من خلال التأثير على التفاعلات التي تحدث بين مكونات العينة والمواد الماصة. هذه التفاعلات فيزيائية بطبيعتها، مثل تأثيرات هيدروفوبية hydrophobic (تبعثري)(dispersive)، تأثيرات كهربائية ثنائي القطب dipole–dipole وأيونية ionic، وغالبًا ما كون مزيجًا من تلك التأثيرات. تتميز تقانة الكروماتوغرافيا السائلة عالية الأداء (HPLC) عن الكروماتوغرافيا السائلة التقليدية («أو ذات الضغط المنخفض») traditional ("low pressure") liquid chromatography بأن ضغوط التشغيل للطور المتحرك عالية بكثير (50-350 بار)، بينما تعتمد كروماتوغرافيا السائل التقليدية (أو العادية) عادةً على قوة الجاذبية لتمرير الطور المتحرك عبر العمود. نظرًا لصغر كمية العينة المفصولة في تقانة HPLC التحليلية، فإن أبعاد العمود النموذجية تكون بحيث قيم نصف قطر العمود تقع ضمن المجال (2.1-4.6 ملم) وقيم طول العمود تنحصر ضمن المجال (30-250 ملم). كما أن أعمدة HPLC تملأ بحشوات من حبيبات أو دقائق ماصة صغيرة adsorbent particles (2-50 ميكرومتر في متوسط حجم الدقائق أو الحبيبات الدقيقة). هذه الأبعاد والخصائص الآنفة الذكر تعطي تقانة الكروماتوغرافيا السائلة عالية الأداء (HPLC) قدرة فصل resolving power فائقة (القدرة على التمييز بين مكونات المزيج المراد فصله) عند فصل الخلائط، مما يجعلها تقنية كروماتوغرافية شائعة الاستخدام وأكثر من باقي أنواع الكروماتوغرافيا السائلة الأخرى. يشتمل المخطط التخطيطي لجهاز الكروماتوغرافيا السائلة عالية الأداء HPLC بشكل نموذجي على مزيل الغازات degasser، وآخذ العينات (أو الحاقن) sampler، والمضخات pumps، والكاشف detector. يقوم جهاز حاقن العينات بإدخال خليط العينة إلى تيار الطور المتحرك الذي يحمله إلى العمود. وتقوم المضخات بتأمين التدفق المطلوب وتركيب الطور المتحرك عبر العمود من مزج مكونات الطور المتحرك (المحلّات). ويولد الكاشف إشارة تتناسب مع كمية كل مكون العينة الذي يخرج تباعاً من العمود، وبالتالي يسمح الكاشف بالتحليل الكمي quantitative analysis لمكونات العينة. يتحكم المعالج الميكرويّ الرقمي digital microprocessor وبرنامج المستخدم في جهاز HPLC ويوفّران تحليل البيانات. يمكن لبعض نماذج المضخات الميكانيكية في جهاز HPLC أن تقوم بمزج عدة مذيبات (محلّات) معًا بنسب تتغير بمرور الوقت، مما يؤدي إلى توليد تدرج في تركيب في الطور المتحرك (وإلى تدرج في قطبية الطور المتحرك). هناك العديد من أجهزة الكشف شائعة الاستخدام، مثل كاشف الأشعة فوق البنفسجية/المرئية مطيافية الأشعة المرئية وفوق البنفسجية، أو كاشف مجموعة ثنائي الضوئي (ثنائي ضوئي (PDA أو كاشف يعتمد على قياس مطيافية الكتلة مطيافية الكتلة. تحتوي معظم أجهزة HPLC أيضًا على فرن العمود column oven يسمح بضبط درجة الحرارة التي يتم عندها إجراء الفصل والتحليل.

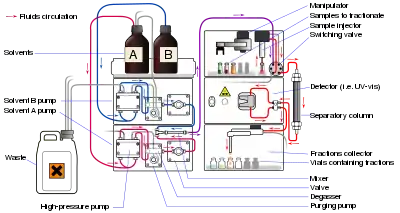
شرح النظرية
يتم ادخال المادة المراد تحليلها في تيار الطور المتحرك. سرعة تحرك المادة المنحلة داخل العمود تتحدد بكم الروابط الفيزيائية أو الكيميائية بينها وبين الطور (الساكن أو الثابت). كمية المادة المنحلة المنحبسة تعتمد على تركيب المادة وتركيب الطور الثابت والطور الناقل أو المتحرك. الوقت الذي تستغرقه المادة المنحبسة داخل العمود لكي تصل للطرف الآخر للعمود وتظهر على الكاشف يسمي وقت الاحتباس أو الاحتفاظ.
إن أجهزة الـ HPLC متوفرة بسهولة لأنها تستخدم في مجالات متعددة منها مجال التقنية الحيوية والتقنية الطبية السريرية والتحاليل الصيدلانية. إضافة إلى استخدامها في الكيمياء ومستحضرات التجميل وفي في مجال الطاقة والبيئة والصناعات الغذائية. كما أن توافر أجهزة بأسعار مقبولة وذات كفاءة متطورة وموثوقة قد جعل أجهزة الـHPLC هي الطريقة المفضلة في التحاليل الصيدلانية وذلك بدءً من إنشاء تركيب الدواء أو فصل مكوناته أو ضبط جودته. لقد تطور استخدام الـHPLC بشكل كبير خلال العقود الماضية ففي الستينات تم وضع الأسس والمبادئ النظرية لهذه التقنية، وأدى التطور في مواد تعبئة عمود الاستشراب (أعمدة الكروماتوغرافيا) في السبعينات إلى تطور الاستشراب بالطور العكوس. وفي الثمانينات أدى التطور في الحواسيب والأتمتة والبرمجيات إلى سهولة استخدام الـ HPLC . وفي التسعينات طورت أعمدة الاستشراب الميكرونية (الصغيرة) وأعمدة الاستشراب المتخصصة لاستعمال محدد، والكواشف Detector المتنوعة، بالإضافة إمكانات الحصول على البيانات المتكاملة وتخزينها واسترجاعها، مما أدى إلى الزيادة الكبيرة في فعالية وسرعة أجهزة الـ HPLC.
التطور التاريخي لتقانة الكروماتوغرافيا السائلة HPLC
قبل أن يستخدم العلماء والخبراء في الكيمياء التحليلية تقنيات الكروماتوغرافية السائلة القياسية، كانت أنظمة الكروماتوغرافيا السائلة غير فعالة إلى حد كبير بسبب معدل تدفق المذيبات التي تعتمد على الجاذبية. وكانت تستغرق عمليات الفصل الكروماتوغرافي ساعات عديدة، وأحيانًا أيامًا حتى تكتمل.[3] كانت كروماتوغرافيا الغازية (Gas chromatography (GC في ذلك الوقت أقوى من الكروماتوغرافيا السائلة (liquid chromatography (LC، ومع ذلك، كان يُعتقد أن فصل الطور الغازي وتحليل البوليمرات الحيوية القطبية ذات الوزن الجزيئي العالي أمر مستحيل. كانت كروماتوغرافيا الغازية GC غير فعالة بالنسبة للعديد من علماء الكيمياء الحيوية بسبب عدم الاستقرار الحراري للمواد المذابة المراد تحليلها.[4] نتيجة لذلك، تم افتراض طرق بديلة والتي أدت مع الوقت إلى تطوير تقانة HPLC. بعد العمل الأساسي الذي قام به Martin و Synge في عام 1941، تنبأ Cal Giddings و Josef Huber وآخرون في الستينيات من القرن التاسع العشر أنه يمكن تشغيل LC في وضع عالي الكفاءة عن طريق تقليل أقطار حبيبات التعبئة (الحشوة) إلى حد كبير أقل مما كان في حالة الكروماتوغرافيا السائلة LC النموذجية (وحالة الكروماتوغرافيا الغازية GC) التي تستخدم حبيبات بأقطار تصل لحوالي 150 ميكرومتر وأيضاً باستخدام ضغوط خارجية لزيادة سرعة الطور المتحرك.[3] وخضعت هذه التنبؤات لتجارب ودراسات مكثفة لفترة امتدت من سنوات الستينيات إلى السبعينيات. وبدأت الأبحاث التطويرية المبكرة في تحسين حبيبات حشوة أعمدة الكروماتوغرافيا السائلة LC، وكان اختراع حبيبات من نوع Zipax، وهو جسيم مسامي سطحيًا، واعدًا لتقنية HPLC.[5] جلبت أعوام السبعينيات العديد من التطورات في الأجهزة والبرمجيات المتعلقة بتقانة الكروماتوغرافيا السائلة ذات الأداء العالي. بدأ الباحثون في استخدام المضخات والحاقن لعمل تصميم أولي لنظام تقانة HPLC.[6] كانت مضخات تضخيم الغاز مثالية Gas amplifier pumps لأنها تعمل بضغط ثابت ولا تتطلب سدادات مانعة للتسرب leak-free seals أو صمامات فحص check valves لتدفق ثابت وكميات جيدة. [4] تم وضع معالم الأجهزة في قسم البوليمرات الصناعية Dupont IPD (Industrial Polymers Division) مثل جهاز التدرج ذي الحجم المنخفض الذي يتم استخدامه بالإضافة إلى استبدال الحاقن الحاجز septum injector بصمام الحقن الحلقي loop injection valve.[4]
بينما كانت التطورات مهمة على مستوى الأجهزة، فإن تاريخ تقانة HPLC يتعلق في المقام الأول بتاريخ وتطور تكنولوجيا الحبيبات أو الجسيمات particle technology.[4] بعد إدخال حبيبات ذات الطبقة المسامية porous layer particles، كان هناك اتجاه ثابت لتقليل حجم تلك الجسيمات لتحسين الكفاءة.[4] ولكن مع تقليل حجم الجسيمات، نشأت مشاكل جديدة. نشأت المشاكل العملية من فرق الضغط المفرط اللازم لدفع السائل المتحرك عبر العمود وأيضاُ صعوبة تحضير حشوة منتظمة التراص والتعبئة من المواد الحبيبية الصغيرة للغاية.[7] في كل مرة يتم تقليل حجم الجسيمات بشكل كبير، يجب أن تحدث جولة أخرى من تطوير الأدوات والأجهزة للتعامل مع فرق الضغط الناشء بين طرفي العمود.[4]
مفاهيم وتعاريف أساسية، ونظرية الكروماتوغرافيا
الطور المتحرك (mobile phase): لفصل مكونات مزيج ما، ندخل السائل المراد فصل مكوناته في تدفق متتابع، وهذا ما يسمى بالطور المتحرك (mobile phase).
الطور الثابت أو الساكن (stationary phase) وتترك الحلالة (المادة المنحلة) لتعبر خلال طبقة عمود الاستشراب الحاوي على مواد (جزيئات) أقطارها صغيرة جداً مما يمنحها سطح تماس كبير، وهذا ما ندعوه بالطور الثابت stationary phase.
الماد المذابة أو الحلالة (الذوائب solutes) وطالما تعبر جزيئات الحلالة عمود الاستشراب محمولة في الطور المتحرك فإنه يتم تأثر Interaction مستمر بين جزيئات الحلالة (أو الذوائب solutes) وبين الطور الثابت وكذلك أيضاً مع الطور المتحرك، وينتج عن هذا توازن ديناميكي dynamic equilibrium. كما يؤدي اختلاف عمليات التوازن هذه إلى فصل مكونات هذا المزيج.
(الإمرار) المتماثل isocratic elution أو الشطف بالطور المتحرك ذي التركيب الثابت وعندما تتم عملية فصل مواد المزيج مع المحافظة على التركيب الثابت لمكونات الطور المتحرك، فإننا ندعو هذه العملية بالشطف (الإمرار) المتماثل isocratic elution.
الشطف المتدرج gradient elution فهو التغير المستمر لتركيب الطور المتحرك كنسبة نوع أو أكثر من المذيبات في الطور المتحرك كتابع للزمن.
كاشف detector عندما تخرج جزيئات الحلالة من مناطق الطور المتحرك فإنها تمر عبر كاشف detector أو سلسلة من الكواشف (المتحريات). وتستجيب إشارات الكاشف كدالة على تركيز الحليلة (المادة المذابة) في قطفات الطور المتحرك التي تخرج من العمود مع الزمن.
برامج تحليل بيانات data processors ترسل هذه الإشارات إلى برامج تحليل بيانات data processors والذي يرسم الخطوط البيانية plot كدالة مع الزمن.
المخطط الاستشرابي chromatogram ويدعى المخطط الذي يظهر هذه الإشارات بالمخطط الاستشرابي chromatogram، وتدعى مناطق المكونات لكل مركب بالقمم الاستشرابية chromatographic peaks . وتتميز هذه القمم بالمعايير (المتثابتات) parameters التالية: العرض، المساحة، ارتفاع القمة، ومدى التذييل tailing، وزمن العبور (الاحتفاظ) retention time. ويدعى الجهاز الذي يقوم بهذ العمل جهاز مخطط الاستشراب (مخطاط الاستشرابي) chromatograph. المحقن injector في الـ HPLC تدخل الجزيئات الذائبة ضمن سيل الطور المتحرك. ويمر هذا السيل عبر مدخل inlet وينبثق عبر مخرج outlet العمود.
المضخة عالية الضغط pump وبما أن أبعاد الأجزاء صغيرة جداً (حوالي 10 ميكرون أو أقل) والعمود مملوء بشكل كامل فإنه لا بد من دفع حركة الطور المتحرك باستخدام مضخات عالية الضغط. وإن الجزيئات الذائبة فقط هي التي تنتقل عبر الطور المتحرك. والجزيئات التي تتفاعل مع سطح العمود سيحدث لها عرقلة impeded بالخروج، والعصبة الناشئة عنها سيحدث لها لفظ متأخر عن لفظ العصبة التي تتثبت جزيئاتها بشكل أضعف. إن النزوح النسبي للذائبة يعتمد على خواصها الحركية والترموديناميكية.
وتختلف المضخات في سعة الضغط، ولكن يتم قياس أدائها على أساس قدرتها على إنتاج معدل تدفق حجمي ثابت وقابل للتكرار. قد يصل الضغط إلى 60 ميجا باسكال (6000 رطل/ بوصة 2)، أو حوالي 600 ضغط جوي. تم تحسين أنظمة HPLC الحديثة للعمل في ضغوط أعلى بكثير، وبالتالي فهي قادرة على استخدام أحجام جزيئات أصغر بكثير في الأعمدة (<2 ميكرومتر). يمكن أن تعمل أنظمة الكروماتوغرافيا السائلة فائقة الأداء هذه أو UHPLCs بسرعة تصل إلى 120 ميجا باسكال (17405 رطل/بوصة 2)، أو حوالي 1200 الغلاف الجوي المصطلح "UHPLCs" هو علامة تجارية لشركة Waters Corporation
الكواشف
تنقسم أجهزة الكشف عن HPLC إلى فئتين رئيسيتين: عالمية أو انتقائية. تقيس أجهزة الكشف العالمية عادةً خاصية الكتلة (على سبيل المثال، معامل الانكسار) عن طريق قياس اختلاف الخاصية المادية بين الطور المتحرك والطور المتحرك باستخدام المذاب بينما تقيس الكاشفات الانتقائية خاصية المذاب (على سبيل المثال، امتصاص الأشعة فوق البنفسجية) عن طريق الاستجابة ببساطة إلى الخصائص الفيزيائية أو الكيميائية للمذاب. [18] يستخدم HPLC بشكل شائع كاشف امتصاص UV-Vis ، ومع ذلك، يمكن استخدام مجموعة واسعة من أجهزة الكشف عن اللوني. كاشف عالمي يكمل الكشف عن امتصاص الأشعة فوق البنفسجية المرئية هو كاشف الأيروسول المشحون (CAD). يشتمل نوع من الكاشفات المستخدمة بشكل شائع على كاشفات معامل الانكسار، والتي توفر قراءات عن طريق قياس التغيرات في معامل الانكسار للشاطف أثناء تحركه عبر خلية التدفق. في حالات معينة، من الممكن استخدام أجهزة كشف متعددة، على سبيل المثال LCMS يجمع عادةً بين UV-Vis مع مطياف الكتلة.
العوامل المؤثرة على كفاءة الفصل
إن مدى وكفاءة الفصل بين قمتي لفظ متقاربتين يعبَّر عنها بعامل الاحتباس أو عامل السعة (retention (or capacity) factor (k’) ، وعامل الاصطفاء selectivity factor ، و عدد الطبقات النظرية N. إن عامل السعة هو قياس زمن التصاق جزيئات الذائبة بأجزاء العمود مقارنة مع زمن التصاقها بالطور المتحرك. لذلك كلما كبرت قيمة K’ كلما زاد التثبت على أجزاء العمود.[8]
أنواع الكروماتوغرافيا السائلة
كروماتوغرافيا التقسيم Partition chromatography

كانت كروماتوغرافيا التقسيم (التشارك أو التوزع) Partition chromatography أحد الأنواع الأولى للكروماتوغرافيا التي طورها الكيميائيون.[9] تم تطبيق مبدأ معامل التقسيم partition coefficient في كروماتوغرافيا الورق وكروماتوغرافيا الطبقة الرقيقة والطور الغازي وتطبيقات فصل سائل ــ سائل. حصل Archer John Porter Martin و Richard Laurence Millington Synge على جائزة نوبل في الكيمياء لعام 1952 لتطويرهما لهذه التقنية، والتي كانت تستخدم لفصل الأحماض الأمينية.[10] يستخدم كروماتوغرافيا التقسيم مذيبًا محتفظًا به، على السطح أو داخل حبيبات أو ألياف مصفوفة داعمة صلبة «خاملة» كما هو الحال مع كروماتوغرافيا الورق؛ أو يستفيد من بعض تأثيرات الكولومبية (الكهربائية الساكنة) و/ أو الهيدروجين مع الطور الثابت. تنقسم مكونات العينة بين الطور الثابت السائل والطور المتحرك eluent. تمامًا كما هو الحال في كروماتوغرافيا التفاعل المحبة للماء (HILIC ؛ تقنية فرعية داخل HPLC)، تفصل هذه الطريقة مكونات المزيج المراد تحليله بناءً على الاختلافات في قطبيتها. غالبًا ما يستخدم HILIC طورًا ثابتًا قطبيًا مرتبطًا وطورًا متحركًا مصنوعًا بشكل أساسي من الأسيتونيتريل مع الماء كمكون قوي. تم استخدام قسم HPLC تاريخيًا على دعامات السيليكا أو الألومينا غير المربوطة unbonded silica. يعمل كل منها بشكل فعال لفصل مكونات العينة المراد تحليلها عن طريق الاختلافات القطبية النسبية. تتميز الأطوار المرتبطة بـ HILIC بميزة فصل المواد المذابة الحمضية والقاعدية والمحايدة في مسار كروماتوغرافي واحد.[11]
تنتشر المواد المنحلة القطبية polar analytes في طبقة مائية ثابتة مرتبطة بالطور القطبي الثابت، وبالتالي يتم الاحتفاظ بها. كلما زادت قوة التفاعلات بين المواد المنحلة القطبية والطور القطبي الثابت (بالنسبة إلى الطور المتحرك)، زاد وقت الشطف elution time. تعتمد قوة التأثير أو التفاعل على طبيعة جزء المجموعات الوظيفية من البنية الجزيئية للمواد المنحلة، مع مجموعات أكثر استقطابًا (على سبيل المثال، هيدروكسيل-) ومجموعات قادرة على الارتباط الهيدروجيني الذي يؤدي إلى مزيد من الاحتفاظ. يمكن أن تزيد التاثيرات الكولومبية (الكهروستاتيكية) أيضًا من الاحتفاظ. سيؤدي استخدام المزيد من المذيبات القطبية في الطور المتحرك إلى تقليل وقت الاحتفاظ بالمواد المنحلة، بينما تميل إضافة المزيد من المذيبات الكارهة للماء إلى زيادة أوقات الاستبقاء.
كروماتوغرافيا الطور العادي
كان كروماتوغرافيا الطور الطبيعي أحد الأنواع الأولى من HPLC التي طورها الكيميائيون. تُعرف هذه الطريقة أيضًا باسم HPLC من النوع العادي (NP-HPLC)، حيث تفصل هذه الطريقة المواد المنحلة المراد فصلها بناءً على تقاربها مع سطح قطبي ثابت مثل السيليكا، ومن ثم فهي تعتمد على قدرة التحليل على الانخراط في التأثيرات القطبية (مثل الترابط الهيدروجيني أو ثنائي القطب) مع السطح الماص. يستخدم NP-HPLC طورًا متحركًا غير قطبي وغير مائي (على سبيل المثال، الكلوروفورم)، ويعمل بشكل فعال لفصل المواد المنحلة القابلة للذوبان بسهولة في المذيبات غير القطبية. يرتبط التحليل بالطورالثابت القطبي ويتم الاحتفاظ بها. تزداد قوة الامتزاز مع زيادة قطبية المواد المنحلة. لا تعتمد قوة التأثير فقط على المجموعات الوظيفية الموجودة في بنية جزيء المواد المنحلة، بل تعتمد أيضًا على العوامل الاستراتجية. يسمح تأثير العائق الفراغي على قوة التأثير لهذه الطريقة بحل أيزومرات بنيوية (منفصلة). سيؤدي استخدام المزيد من المذيبات القطبية في الطور المتحرك إلى تقليل وقت الاحتفاظ بالمواد المنحلة، في حين تميل المزيد من المذيبات الكارهة للماء إلى إحداث شطف أبطأ (زيادة أوقات الاحتفاظ). تميل المذيبات القطبية للغاية مثل آثار الماء في الطور المتحرك إلى الامتصاص إلى السطح الصلب للطور الثابت مكونًا طبقة ثابتة (مائية) والتي تلعب دورًا نشطًا في الاحتفاظ. هذا السلوك غريب إلى حد ما بالنسبة لكروماتوغرافيا الطور الطبيعي لأنه محكوم بشكل حصري تقريبًا بآلية امتزاز (على سبيل المثال، تتفاعل المواد المنحلة مع سطح صلب بدلاً من الطبقة المذابة ليجند متصل بالسطح الماص؛ انظر أيضًا HPLC ذو المرحلة العكسية أدناه). لا يزال كروماتوغرافيا الامتزاز مستخدمة على نطاق واسع لفصل الأيزومرات الهيكلية في كل من تنسيقات كروماتوغرافيا العمود والطبقة الرقيقة على دعامات السيليكا أو الألومينا المنشط (المجفف). فشلت أنواع الكروماتوغرافية التقسيمية و NP-HPLC في السبعينيات مع تطوير كروماتوغرافيا HPLC ذات الأطوار العكسية بسبب ضعف استنساخ نتائج أوقات الاحتفاظ بسبب وجود طبقة مذيبات عضوية مائية أو بروتونية على سطح السيليكا أو وسط كروماتوغراف الألومينا . تتغير هذه الطبقة مع أي تغييرات في تكوين الطور المتحرك (على سبيل المثال، مستوى الرطوبة) مما يتسبب في أوقات استبقاء الانجراف. في الآونة الأخيرة، أصبح الفصل الكروماتوغرافي شائعًا مرة أخرى مع تطور مراحل الارتباط الهيليك "Hilic" التي تُظهر تحسين استنساخ نتائج، ونتيجة لفهم أفضل لنطاق فائدة هذه التقنية.
كروماتوغرافيا الإزاحة
المبدأ الأساسي لكروماتوغرافيا الإزاحة displacement chromatography هو: إن الجزيء ذو الألفة العالية لركازة الكروماتوغرافيا (المزيح displacer) سوف يتنافس بفعالية على مواقع الربط، وبالتالي يزيح جميع الجزيئات ذات الألفة الأقل.[12] هناك اختلافات واضحة بين كروماتوغرافيا الإزاحة وكروماتوغرافيا الشطف elution chromatography. في وضع كروماتوغرافيا الشطف، تظهر المواد عادةً من عمود في قمم غاوسية ضيقة Gaussian peaks. مطلوب فصل واسع للقمم، مفضل عن خط الأساس baseline، من أجل تحقيق أقصى تنقية. تعتمد السرعة التي ينتقل بها أي مكون من خليط إلى أسفل العمود في وضع كروماتوغرافيا الشطف على العديد من العوامل. ولكن لكي تنتقل مادتان بسرعات مختلفة، وبالتالي يتم حلهما، يجب أن تكون هناك اختلافات جوهرية في بعض التفاعلات بين الجزيئات الحيوية وركازة الكروماتوغرافيا. يتم ضبط متحولات التشغيل لتعظيم تأثير هذا الاختلاف. في كثير من الحالات، لا يمكن تحقيق الفصل الأساسي للقمم إلا من خلال شطف التدرج وتحميل العمود المنخفض. وبالتالي، هناك عيبان في كروماتوغرافيا وضع الشطف، خاصة في المقياس التحضيري، وهما التعقيد التشغيلي، بسبب ضخ المذيبات المتدرج، والإنتاجية المنخفضة، بسبب التحميل المنخفض للعمود. يتميز كروماتوغرافيا الإزاحة بمزايا تفوق كروماتوغرافيا الشطف حيث يتم حل المكونات في مناطق متتالية من المواد النقية بدلاً من «القمم». نظرًا لأن العملية تستفيد من عدم خطية متساوي الحرارة، يمكن فصل تغذية عمود أكبر على عمود معين مع استرداد المكونات النقية بتركيز أعلى بكثير.
كروماتوغرافيا السائلة ذات الطور العكسي
تحتوي HPLC ذات الطور العكسي (RP-HPLC) على طور ثابت غير قطبي وطور متحرك مائي قطبي معتدل. إحدى الأطور الثابتة الشائعة هي السيليكا التي تم تعديل سطحها باستخدام المادة RMe2SiCl، حيث R عبارة عن مجموعة ألكيل مستقيمة مثل C18H37 أو C8H17. مع مثل هذه الأطوار الثابتة، يكون وقت الاستبقاء أطول للجزيئات الأقل قطبية، بينما يتم التخلص من الجزيئات القطبية بسهولة أكبر (في وقت مبكر من التحليل). يمكن للمحلل المخبري زيادة أوقات الاحتفاظ عن طريق إضافة المزيد من الماء إلى الطور المتحرك؛ مما يجعل ألفة المادة التحليلية الكارهة للماء للطورالثابت الكاره للماء أقوى مقارنة بالطور المتحرك الأكثر مقاومة للماء الآن. وبالمثل، يمكن للمحلل المخبري تقليل وقت الاحتفاظ عن طريق إضافة المزيد من المذيبات العضوية إلى الطور المتحرك eluent. يتم استخدام RP-HPLC بشكل شائع لدرجة أنه غالبًا ما يشار إليه بشكل غير صحيح باسم "HPLC" دون مزيد من المواصفات. تستخدم صناعة الأدوية بانتظام نوع الكروماتوغرافيا RP-HPLC لضمان جودة الأدوية قبل إطلاقها. يعمل RP-HPLC على مبدأ التفاعلات الكارهة للماء، والتي تنشأ من التناظر العالي في بنية الماء ثنائي القطب ويلعب الدور الأكثر أهمية في جميع العمليات في علوم الحياة. يسمح RP-HPLC بقياس هذه القوى التفاعلية. يتناسب ارتباط المادة المنحلة بالطور الثابت مع مساحة سطح التلامس حول الجزء غير القطبي من جزيء المادة المنحلة عند الارتباط بالرابط في الطورالثابت. هذا التأثير المضاد للذوبان تهيمن عليه قوة الماء من أجل «تقليل التجويف» حول المادة المنحلة وسلسلة C18 مقابل مجمع كليهما. الطاقة المنبعثة في هذه العملية تتناسب طرديًا مع التوتر السطحي للشاطف (الماء: 7.3 × 10 /6 جول / سم 2، الميثانول: 2.2 × 10 /6 جول / سم 2) والسطح الكارهة للماء من الحليلة والمرتبطة (المعقد) ligand على التوالي . يمكن تقليل الاحتباس عن طريق إضافة مذيب أقل قطبية (ميثانول، أسيتونتريل) إلى الطور المتحرك لتقليل التوتر السطحي للماء. يستخدم شطف التدرج هذا التأثير عن طريق التقليل التلقائي للقطبية والتوتر السطحي للطور المتحرك المائية أثناء التحليل. تلعب الخصائص الهيكلية للجزيء المادة المنحلة دورًا مهمًا في خصائص الاحتفاظ به. بشكل عام، يتم الاحتفاظ بالتحليل ذي المساحة السطحية الكارهة للماء (C-H ، C-C ، والروابط الذرية غير القطبية عمومًا، مثل S-S وغيرها) لفترة أطول لأنه لا يتفاعل مع بنية الماء. من ناحية أخرى، فإن المواد المنحلة ذات المساحة السطحية القطبية الأعلى (التي يمنحها وجود المجموعات القطبية، مثل -OH أو -NH2 أو COO− أو -NH3 + في هيكلها) أقل احتفاظًا بها حيث يتم دمجها بشكل أفضل في الماء. تخضع مثل هذه التفاعلات لتأثيرات فراغية في تلك الجزيئات الكبيرة جدًا قد يكون لها وصول محدود فقط إلى مسام الطورالثابت، حيث تحدث التفاعلات مع الروابط السطحية (سلاسل الألكيل). عادة ما ينتج عن عائق السطح هذا احتباس أقل.
يزيد وقت الاستبقاء مع مساحة السطح الكارهة للماء (غير القطبية). تتخلص مركبات السلاسل المتفرعة بسرعة أكبر من الأيزومرات الخطية المقابلة لها بسبب تناقص مساحة السطح الإجمالية. وبالمثل يتم التخلص من المركبات العضوية ذات الروابط C-C المفردة في وقت لاحق من تلك التي تحتوي على رابطة ثلاثية C = C أو C-C ، حيث أن الرابطة المزدوجة أو الثلاثية أقصر من رابطة C-C مفردة.
بصرف النظر عن التوتر السطحي للطور المتحرك (القوة التنظيمية في هيكل eluent)، يمكن أن تؤثر معدلات الطور المتحرك الأخرى على الاحتفاظ بالمادة المنحلة. على سبيل المثال، تؤدي إضافة الأملاح غير العضوية إلى زيادة خطية معتدلة في التوتر السطحي للمحاليل المائية (حوالي 1.5 × 10 J7 جول/سم2 لكل مول لكلوريد الصوديوم، 2.5 × 10−7 جول/ سم2 لكل مول لـ (NH4) 2SO4)، ولأن إنتروبية entropy سطح التماس بين المذيبات والمادة المنحلة يتم التحكم فيها عن طريق التوتر السطحي، فإن إضافة الأملاح تميل إلى زيادة وقت الاستبقاء. تُستخدم هذه التقنية للفصل الطفيف واستعادة البروتينات وحماية نشاطها البيولوجي في تحليل البروتين (كروماتوغرافيا التفاعل الكارهة للماء، HIC).
عامل مهم آخر هو درجة الحموضة في الطور المتحرك لأنه يمكن أن يغير الطبيعة الكارهة للماء للمادة المنحلة. لهذا السبب، تستخدم معظم الطرق عامل تخزين مؤقت، مثل فوسفات الصوديوم، للتحكم في درجة الحموضة. تخدم المحاليل الموقية Buffers أغراضًا متعددة: التحكم في الأس الهيدروجيني، وتحييد الشحنة على سطح السيليكا في الطورالثابت والعمل كعوامل إقران أيون لتحييد شحنة التحليل. يضاف فورمات الأمونيوم بشكل شائع في قياس الطيف الكتلي لتحسين الكشف عن بعض المواد المنحلة عن طريق تكوين مقاربات الأمونيوم التحليلية. غالبًا ما يضاف حمض عضوي متطاير مثل حمض الأسيتيك، أو حمض الفورميك الأكثر شيوعًا، إلى الطور المتحرك إذا تم استخدام مقياس الطيف الكتلي لتحليل العمود المائل. يستخدم حمض Trifluoroacetic بشكل غير منتظم في تطبيقات قياس الطيف الكتلي نظرًا لثباته في الكاشف ونظام توصيل المذيبات، ولكن يمكن أن يكون فعالًا في تحسين الشبكية ntion من المواد المنحلة مثل الأحماض الكربوكسيلية في التطبيقات التي تستخدم أجهزة الكشف الأخرى، حيث أنه حمض عضوي قوي إلى حد ما. تختلف تأثيرات الأحماض والمحاليل الموقية باختلاف التطبيق ولكنها تعمل بشكل عام على تحسين دقة الكروماتوغرافيا.
من الصعب جدًا إتلاف أعمدة الطور المعكوس مقارنةً بأعمدة السيليكا العادية ؛ ومع ذلك، تتكون العديد من أعمدة الطور المعكوس من جزيئات السيليكا المشتقة من الألكيل ولا يجب استخدامها مع القواعد المائية لأنها ستدمر جسيم السيليكا الأساسي. يمكن استخدامها مع حمض مائي، ولكن لا ينبغي أن يتعرض العمود للحمض لفترة طويلة، حيث يمكن أن يؤدي ذلك إلى تآكل الأجزاء المعدنية لجهاز HPLC. يجب شطف أعمدة RP-HPLC بمذيب نظيف بعد استخدامها لإزالة الأحماض المتبقية أو المحاليل، وتخزينها في تركيبة مناسبة من المذيب. يجب أن يظل المحتوى المعدني لأعمدة HPLC منخفضًا إذا كان يجب الاحتفاظ بأفضل قدرة ممكنة لفصل المواد. الاختبار الجيد للمحتوى المعدني للعمود هو حقن عينة عبارة عن خليط من 2,2'- و 4,4'-bipyridine. نظرًا لأن 2,2'-bipy يمكن أن يخلب المعدن، فسيتم تشويه شكل ذروة 2,2'-bipy (ذيول) عندما توجد أيونات معدنية على سطح السيليكا. [بحاجة لمصدر] ..
كروماتوغرافيا الاستبعاد الحجمي
كروماتوغرافيا الاستبعاد الحجمي (SEC)، والمعروفة أيضًا باسم كروماتوغرافيا نفاذية الهلام أو كروماتوغرافيا الترشيح الهلامي، تفصل الجسيمات على أساس الحجم الجزيئي (في الواقع بواسطة نصف قطر ستوكس للجسيم). وهو بشكل عام كروماتوغرافيا منخفضة الدقة، وبالتالي فإنه غالبًا ما يكون محجوزة لخطوة «التصفية» النهائية للتنقية. كما أنها مفيدة في تحديد البنية الثلاثية والبنية الرباعية للبروتينات المنقاة. تستخدم SEC بشكل أساسي لتحليل الجزيئات الكبيرة مثل البروتينات أو البوليمرات. تعمل SEC عن طريق محاصرة هذه الجزيئات الأصغر في مسام الجسيم. تمر الجزيئات الأكبر ببساطة عبر المسام لأنها أكبر من أن تدخل المسام. وبالتالي، فإن الجزيئات الأكبر تتدفق عبر العمود بشكل أسرع من الجزيئات الأصغر، أي أنه كلما كان الجزيء أصغر، زاد وقت الاحتفاظ.
تستخدم هذه التقنية على نطاق واسع لتحديد الوزن الجزيئي للسكريات. SEC هي التقنية الرسمية (التي اقترحها دستور الأدوية الأوروبي) لمقارنة الوزن الجزيئي لمختلف الهيبارين منخفض الوزن الجزيئي المتاح تجاريًا.
كروماتوغرافيا التبادل الأيوني
في كروماتوغرافيا التبادل الأيوني (IC)، يعتمد الاستبقاء على التجاذب بين الأيونات المنحلة والمواقع المشحونة المرتبطة بالطور الثابت. يتم استبعاد الأيونات المذابة بنفس الشحنة مثل المواقع المشحونة بالعمود من الربط، بينما يتم الاحتفاظ بالأيونات المذابة للشحنة المعاكسة للمواقع المشحونة للطور الثابت في العمود. يمكن التخلص من الأيونات المذابة التي يتم الاحتفاظ بها في الطور الثابت من العمود عن طريق تغيير شروط المذيب في الطور المتحرك الشاطف (على سبيل المثال، زيادة التأثير الأيوني لنظام المذيب عن طريق زيادة تركيز الملح في المحلول، وزيادة درجة حرارة العمود، وتغيير الرقم الهيدروجيني للمذيب، إلخ).
تشمل أنواع المبادلات الأيونية راتنجات البوليسترين، ومبادلات أيونات السليلوز والديكستران (المواد الهلامية)، والزجاج ذي المسام الخاضعة للتحكم أو السيليكا المسامية. تسمح راتنجات البوليسترين بالربط المتقاطع الذي يزيد من ثبات السلسلة. يقلل الارتباط المتقاطع العالي من الانحراف، مما يزيد من وقت الموازنة ويحسن الانتقائية في النهاية. تمتلك مبادلات أيونات السليلوز والديكستران أحجام مسام أكبر وكثافة منخفضة الشحن مما يجعلها مناسبة لفصل البروتين.
بشكل عام، تفضل المبادلات الأيونية ربط الأيونات ذات الشحنة الأعلى ونصف القطر الأصغر.
زيادة تركيز الأيون المضاد (فيما يتعلق بالمجموعات الوظيفية في الراتنجات) يقلل من وقت الاستبقاء. يقلل انخفاض الرقم الهيدروجيني من وقت الاستبقاء في تبادل الكاتيونات بينما تقلل الزيادة في الرقم الهيدروجيني من وقت الاحتفاظ في تبادل الأنيون. عن طريق خفض الرقم الهيدروجيني للمذيب في عمود التبادل الكاتيوني، على سبيل المثال، يتوفر المزيد من أيونات الهيدروجين للتنافس على المواضع على الطور الثابت الأنيوني، وبالتالي سيتم شطف الكاتيونات ضعيفة الارتباط.
يستخدم هذا النمط من الكروماتوغرافيا على نطاق واسع في التطبيقات التالية: تنقية المياه، والتركيز المسبق للمكونات النزرة، وكروماتوغرافيا التبادل الترابطي، وكروماتوغرافيا التبادل الأيوني للبروتينات، وكروماتوغرافيا التبادل الأنيوني عالي الحموضة للكربوهيدرات والسكريات قليلة الحموضة، وغيرها.
كروماتوغرافيا ذات الألفة الحيوية
تعتمد هذه العملية الكروماتوغرافية على خاصية المواد النشطة بيولوجيا لتشكيل معقدات complexes مستقرة ومحددة وقابلة للعكس. يتضمن تكوين هذه المعقدات مشاركة القوى الجزيئية المشتركة مثل تأثيرات قوى فاندر فالس Van der Waals والتأثير الكهروستاتيكي وتأثير ثنائي القطب والألفة الهيدروفيلية ورابطة الهيدروجين. يتم تكوين رابطة بيولوجية فعالة ونوعية من خلال اجتماع متضافر للعديد من هذه القوى في مواقع النشطة التفاعلية في الطور الكروماتوغرافي.
كروماتوغرافيا الطور العادي المائي
كروماتوغرافيا الطور العادي المائي وبالإنكليزية Aqueous normal-phase chromatography (ANP) هي تقنية كروماتوغرافية تشمل منطقة الطور المتحرك (خيارات تركيب الطور المتحرك) بين كروماتوغرافيا الطور العكسي reversed-phase chromatography (RP) __التي فيها الطور المتحرك هو أكثر قطبية من الطور الثابت__ وكروماتوغرافيا الطور الطبيعي العضوي organic normal phase chromatography (ONP) التي يتصف الطور المتحرك بقطبية أقل من الطور الثابت. تُستخدم هذه التقنية لتحقيق انتقائية فريدة للمركبات المحبة للماء (هيدروفيلية)، مما يُظهر قدرة الشطف للطور العادي باستخدام مذيبات عضوية عكسية الطور. [بحاجة لمصدر]
الشطف مع طور متحرك إيزوقراطي ومتدرج
بالإنكليزية (Isocratic and gradient elution)

يُطلق على الفصل الذي يظل فيه تكوين الطور المتحرك ثابتًا طوال الإجراء اسمًا إيزوقراطيًا Isocratic(يعني التكوين الثابت). (على سبيل المثال، ستبقى النسبة المئوية للميثانول طوال الإجراء ثابتة ، أي 10٪) الكلمة صاغها سابا هورفاث Csaba Horvath الذي كان أحد رواد تقانة HPLC. [بحاجة لمصدر]،
لا يجب أن يظل تكوين الطور المتحرك ثابتًا. يوصف الفصل الذي يتغير فيه تكوين الطور المتحرك أثناء عملية الفصل بأنه شطف متدرج. أحد الأمثلة هو التدرج اللوني الذي يبدأ عند 10٪ ميثانول وينتهي عند 90٪ ميثانول بعد 20 دقيقة. ويطلق على عنصري الطور المتحرك اسم "A" و "B"؛ A هو المذيب «الضعيف» الذي يسمح للمذاب (المادة المنحلة) بالتخلص ببطء فقط، بينما B هو المذيب «القوي» الذي يزيل المواد المذابة بسرعة من العمود. في كروماتوغرافيا الطور العكسي، غالبًا ما يكون المذيب A عبارة عن ماء أو محلول مائي ، بينما B عبارة عن مذيب عضوي قابل للامتزاج بالماء، مثل الأسيتونتريل أو الميثانول أو رباعي هيدرو الفوران THF أو الأيزوبروبانول.
في الشطف المتساوي ، يزداد عرض الذروة مع زمن الاستبقاء خطيًا وفقًا لمعادلة N ، عدد الصفائح النظرية. هذا يؤدي إلى عيب أن القمم المتأخرة تصبح مسطحة وواسعة للغاية. قد يمنعها شكلها وعرضها من التعرف عليها على أنها قمم. يقلل شطف التدرج من الاحتفاظ بمكونات التصفية اللاحقة بحيث تتم إزالتها بشكل أسرع، مما يعطي قممًا أضيق (وأطول) لمعظم المكونات. يعمل هذا أيضًا على تحسين شكل الذروة للقمم الذيلية ، حيث يدفع التركيز المتزايد للشاطف العضوي جزء الذيل من الذروة إلى الأمام. يؤدي هذا أيضًا إلى زيادة ارتفاع الذروة (تبدو القمة «أكثر حدة»)، وهو أمر مهم في تحليل التتبع. قد يتضمن برنامج التدرج زيادات مفاجئة «خطوة» في النسبة المئوية للمكون العضوي ، أو منحدرات مختلفة في أوقات مختلفة - كل ذلك وفقًا للرغبة في الفصل الأمثل في أقل وقت ممكن.
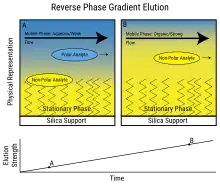
في الشطف المتساوي ، لا تتغير الانتقائية إذا تغيرت أبعاد العمود (الطول والقطر الداخلي) - أي يتم فصل القمم بنفس الترتيب. في شطف التدرج ، قد يتغير ترتيب الشطف مع تغير الأبعاد أو معدل التدفق. [بحاجة لمصدر]
تنشأ القوة الدافعة في كروماتوغرافيا الطور المعكوس في الترتيب العالي لهيكل الماء. يتمثل دور المكون العضوي في الطور المتحرك في تقليل هذا الترتيب المرتفع وبالتالي تقليل قوة التثبيط للمكون المائي.
التشغيل
يتم إدخال خليط العينة المراد فصله وتحليله، في حجم صغير منفصل (عادةً ميكروليتر)، في تيار الطور المتحرك المتسرب عبر العمود. تتحرك مكونات العينة عبر العمود بسرعات مختلفة، وهي تابعة لتأثيرات فيزيائية محددة مع مادة الامتصاص (وتسمى أيضًا الطور الساكن أو الثابت stationary phase). تعتمد سرعة كل مكون على طبيعته الكيميائية وعلى طبيعة الكيميائية للطور الساكن في العمود وعلى تركيب الطور المتحرك. يُطلق على الوقت الذي يتم فيه فصل مادة تحليلية معينة elution (يخرج من العمود) اسم وقت الاحتفاظ أو الاستبقاء retention time. وقت الاستبقاء المقاس في ظل ظروف معينة هو خاصية تعريف لتحليل معين. تتوفر العديد من أنواع الأعمدة المختلفة، المليئة بمواد ممتزة متفاوتة في حجم الجسيمات وطبيعة سطحها («كيمياء السطح»). يتطلب استخدام مواد التعبئة ذات الأحجام الصغيرة للجسيمات استخدام ضغط تشغيلي أعلى (الضغط الخلفي backpressure) وعادة ما يحسن دقة الفصل الكروماتوغرافية (درجة الفصل للذروة بين مكونات المتتالية الخارجة من العمود). قد تكون الجسيمات الممتزة كارهة للماء hydrophobic أو قطبية بطبيعتها.
تشتمل الأطوار المتحركة الشائعة الاستخدام على أي مزيج قابل للامتزاج من الماء مع المذيبات العضوية المختلفة (الأكثر شيوعًا هي الأسيتونيتريل والميثانول). تستخدم بعض تقنيات HPLC أطوار متحركة خالية من الماء (انظر كروماتوغرافيا الطور الطبيعي normal-phase chromatography أدناه). قد يحتوي المكون المائي للطور المتحرك على أحماض (مثل حمض الفورميك أو الفوسفوريك أو ثلاثي فلورو أسيتيك) أو أملاح للمساعدة في فصل مكونات العينة. قد يظل تركيب الطور المتحرك ثابتًا (وضع الشطف المتساوي isocratic elution mode) أو متغيراً (وضع الشطف المتدرج gradient elution mode) أثناء التحليل الكروماتوغرافي. عادة ما يكون الشطف المتساوي فعالًا في فصل مكونات العينة التي تختلف اختلافًا كبيرًا في ألفتها الكيميائية مع الطور الثابت. في الشطف المتدرج، يتنوع تركيب الطور المتحرك نموذجيًا من قوة الشطف المنخفضة إلى عالية. تنعكس قوة الشطف للطور المتحرك من خلال أزمنة احتفاظ ذات قوة تصفية عالية والتي تنتج شطفًا سريعًا (أزمنة احتفاظ قصيرة). نموذجياً يمكن أن يبدأ برنامج التدرج للطور المتحرك في كروماتوغرافيا الطور المعكوس عند 5٪ أسيتونيتريل (في الماء أو محلول موقي مائي aqueous buffer) ويرتفع خطيًا إلى 95٪ أسيتونيتريل خلال 5-25 دقيقة. قد تكون فترات ثبات تركيب الطور المتحرك جزءًا من برنامج التدرج التشغيلي. على سبيل المثال، يمكن الاحتفاظ بتركيب الطور المتحرك ثابتًا عند تركيب 5٪ أسيتونيتريل لمدة 1-3 دقائق، ثم يجري تغيير خطي يصل إلى 95٪ أسيتونيتريل.

يعتمد التركيب المختار للطور المتحرك (ويسمى أيضًا الشاطف eluent) على شدة التفاعلات بين مكونات العينة المختلفة (analytes) والطور الساكن (على سبيل المثال، التفاعلات الكارهة للماء في كروماتوغرافيا السائلة ذات الطور المعكوس). اعتمادًا على الفتهم الكيميائية مع الطورين المتحرك والساكن تتوزع partition مكونات العينة المختلفة بين الاثنين أثناء عملية الفصل التي تحدث في العمود. تشبه عملية التوزيع partition تلك التي تحدث أثناء الاستخلاص السائل ـ السائل liquid–liquid extraction ولكنها مستمرة وليست تتم عبر مراحل تشغيلية step-wise. في هذا المثال، باستخدام التدرج اللوني للماء/الأسيتونتريل، ستتم إزالة المزيد من المكونات الكارهة للماء (الهيدروفوبية) من الطور الساكن (أي تخرج من العمود) في وقت متأخر، بمجرد أن يصبح الطور المتحرك أكثر تركيزًا في الأسيتونيتريل (أي في الطور المتحرك ذي قوة التصفية العالية من جراء تزايد هيدروفوبية المحلول الشاطف). يعتمد اختيار مكونات الطور المتحرك والإضافات (مثل الأملاح أو الأحماض) وشروط التدرج على طبيعة العمود ومكونات العينة. غالبًا ما يتم إجراء سلسلة من العمليات التجريبية مع العينة من أجل إيجاد طريقة HPLC التي تعطي فصلًا مناسبًا.
التطبيقات
في مجال تصنيع المواد Manufacturing
هناك تطبيقات عديدة لتقانة الكروماتوغرافيا السائلة ذات الأداء العالي HPLC في العلوم المختبرية والسريرية. إنها تقنية شائعة تستخدم في تطوير المنتجات الصيدلانية، لأنها طريقة يمكن الاعتماد عليها للحصول على نقاوة المنتج وضمان جودته.[14] بينما يمكن أن تنتج تقانة HPLC منتجات عالية الجودة (نقية)، إلا أنه ليس دائمًا الطريقة الأساسية المستخدمة في إنتاج مواد الأدوية السائبة bulk drug materials.[15] وفقًا لدستور الأدوية الأوروبي European pharmacopoeia، يتم استخدام HPLC في 15.5٪ فقط من التركيبات (الاصطناعات) syntheses.[15] According to the European pharmacopoeia, HPLC is used in only 15.5% of syntheses.[16] ومع ذلك، فإنه يلعب دورًا في 44٪ من التركيبات في دستور الأدوية في الولايات المتحدة United States pharmacopoeia.[17] قد يكون هذا بسبب الاختلافات في القيود النقدية والزمنية، حيث يمكن أن تكون تقانة HPLC على نطاق التطبيق الأوسع تقنية باهظة الثمن. إن الزيادة في الخصوصية والدقة والدقة التي تحدث مع تقانة HPLC تقابل للأسف زيادة في التكلفة.
في مجال الرقابة القانونية
تُستخدم هذه التقنية أيضًا للكشف عن العقاقير غير المشروعة في البول. الطريقة الأكثر شيوعًا للكشف عن المخدرات هي المقايسة المناعية مقايسة مناعية.[18] هذه الطريقة أكثر ملاءمة. ومع ذلك، تأتي الراحة على حساب خصوصية وتغطية مجموعة واسعة من الأدوية. نظرًا لأن HPLC هي طريقة لتحديد (وربما زيادة) النقاء، فإن استخدام HPLC وحده في تقييم تراكيز الأدوية غير كافٍ إلى حد ما. مع هذا، غالبًا ما يتم إجراء تحليل HPLC في هذا السياق جنبًا إلى جنب مع قياس الطيف الكتلي mass spectrometry (MS).[19] استخدام الكروماتوغرافيا السائلة بدلاً من كروماتوغرافيا الغاز بالتزامن مع مطيافية الكتلة MS يتحايل على ضرورة الاشتقاق باستخدام عوامل الأسيتيل أو الألكلة، والتي يمكن أن تكون خطوة إضافية مرهقة.[20] تم استخدام هذه التقنية للكشف عن مجموعة متنوعة من العوامل مثل المنشطات doping agents، ومستقلبات الأدوية ، وتقارن الجلوكورونيد glucuronide conjugates، والأمفيتامينات amphetamines، والمواد الأفيونية opioids، والكوكايين cocaine، و BZDs ، والكيتامين ketamine، و LSD ، والقنب cocaine، والمبيدات الحشرية pesticides.[21][22] يؤدي أداء HPLC جنبًا إلى جنب مع قياس الطيف الكتلي إلى تقليل الحاجة المطلقة إلى إجراء المعايرة standardization في عمليات التشغيل التجريبية لـ HPLC.
في مجال الابحاث
يمكن إجراء فحوصات مماثلة لأغراض البحث، والكشف عن تراكيز مواد السريرية المحتملة مثل الأدوية المضادة للفطريات anti-fungal والربو asthma drugs.[23] من الواضح أن هذه التقنية مفيدة في مراقبة الأنواع المتعددة في العينات التي تم جمعها أيضًا، ولكنها تتطلب استخدام محاليل عيارية قياسية محلول قياسي عند البحث عن معلومات حول هوية الأنواع. يتم استخدامه كطريقة لتأكيد نتائج التفاعلات التركيبية synthesis reactions ، حيث أن النقاوة purity ضرورية في هذا النوع من البحث. ومع ذلك، لا يزال قياس الطيف الكتلي mass spectrometry هو الطريقة الأكثر موثوقية لتحديد الأنواع.
في المجال الطبي
يمكن أن يشمل الاستخدام الطبي لتقانة HPLC تحليل الأدوية drug analysis، ولكنه يقع بشكل وثيق ضمن فئة تحليل المغذيات nutrient analysis. في حين أن البول هو الوسيلة الأكثر شيوعًا لتحليل تركيزات الأدوية، فإن مصل الدم blood serum هو العينة التي يتم جمعها لمعظم التحليلات الطبية باستخدام HPLC.[24] تم اختبار طرق أخرى للكشف عن الجزيئات المفيدة للدراسات السريرية ضد HPLC ، وهي المقايسات المناعية immunoassays. في أحد الأمثلة على ذلك، تمت مقارنة فحوصات ربط البروتين التنافسية competitive protein binding assays (CPBA) وتقانة HPLC من أجل الحساسية في الكشف عن فيتامين د. مفيد في تشخيص نقص فيتامين د لدى الأطفال ، وقد وجد أن حساسية ونوعية هذا CPBA وصلت فقط إلى 40٪ و 60٪، على التوالي، من قدرة تحاليل HPLC.[25] على الرغم من كونها أداة باهظة الثمن، إلا أن دقة تقانة HPLC لا مثيل لها تقريبًا.
المراجع
- القاموس الطبي الموحد. نسخة محفوظة 08 ديسمبر 2017 على موقع واي باك مشين.
- Gerber, F.؛ Krummen, M.؛ Potgeter, H.؛ Roth, A.؛ Siffrin, C.؛ Spoendlin, C. (2004)، "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice"، Journal of Chromatography A، 1036 (2): 127–133، doi:10.1016/j.chroma.2004.02.056، PMID 15146913.
- Karger, Barry L. (1997)، "HPLC: Early and Recent Perspectives"، Journal of Chemical Education، 74 (1): 45، Bibcode:1997JChEd..74...45K، doi:10.1021/ed074p45.
- Henry, Richard A. (1 February 2009) "The Early Days of HPLC at Dupont". Chromatography Online. Avanstar Communications Inc. نسخة محفوظة 1 أغسطس 2020 على موقع واي باك مشين.
- Iler, R.K. (1979) The Chemistry of Silica. John Wiley & Sons. New York.
- Karger, B. L.؛ Berry, L. V. (1971)، "Rapid liquid-chromatographic separation of steroids on columns heavily loaded with stationary phase"، Clin. Chem.، 17 (8): 757–64، PMID 4254537.
- Giddings, J. Calvin (1965) Dynamics of Chromatography, Part I. Principles and Theory. Marcel Dekker, Inc., New York. p. 281.
- (PDF) https://web.archive.org/web/20120617061134/http://www.cem.msu.edu/~cem333/Week16.pdf، مؤرشف من الأصل (PDF) في 17 يونيو 2012.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - Ettre, C. (2001)، "Milestones in Chromatography: The Birth of Partition Chromatography" (PDF)، LCGC، 19 (5): 506–512، مؤرشف من الأصل (PDF) في 6 أكتوبر 2016، اطلع عليه بتاريخ 26 فبراير 2016.
- Martin, A J P؛ Synge, R L M (1941)، "Separation of the higher monoamino-acids by counter-current liquid-liquid extraction: the amino-acid composition of wool"، Biochemical Journal، 35 (1–2): 91–121، doi:10.1042/bj0350091، PMC 1265473، PMID 16747393.
- Lindsay, S.؛ Kealey, D. (1987)، High performance liquid chromatography، Wiley، OSTI 7013902. from review Hung, L. B.؛ Parcher, J. F.؛ Shores, J. C.؛ Ward, E. H. (1988)، "Theoretical and experimental foundation for surface-coverage programming in gas–solid chromatography with an adsorbable carrier gas"، J. Am. Chem. Soc.، 110 (11): 1090–1096، doi:10.1021/ac00162a003.
{{استشهاد بدورية محكمة}}: الوسيط|archive-url=بحاجة لـ|url=(مساعدة) - Displacement Chromatography. Sacheminc.com. Retrieved 2011-06-07. نسخة محفوظة September 15, 2008, على موقع واي باك مشين.
- Morgan, David J. (19 نوفمبر 2003)، "Fraction collector (post on Flickr)"، Flickr، مؤرشف من الأصل في 7 ديسمبر 2020، اطلع عليه بتاريخ 28 أكتوبر 2015.
- Gerber, Frederic (مايو 2004)، "Practical aspects of fast reversed-phase high-performance liquid chromatography using 3 μm particle packed columns and monolithic columns in pharmaceutical development and production working under current good manufacturing practice"، Journal of Chromatography، 1036 (2): 127–33، doi:10.1016/j.chroma.2004.02.056، PMID 15146913.
- Siddiqui, Masoom Raza؛ AlOthman, Zeid A.؛ Rahman, Nafisur (2013)، "Analytical techniques in pharmaceutical analysis: A review"، Arabian Journal of Chemistry، 10: S1409–S1421، doi:10.1016/j.arabjc.2013.04.016.
- The European Pharmacopoeia, 2002. fourth ed., Council of Europe, Strasbourg.
- United States Pharmacopoeia, 2004. 27th ed. The USP Convention Inc., Rockville, MD.
- Pesce, Amadeo؛ Rosenthal, Murray؛ West, Robert؛ West, Cameron؛ Crews, Bridgit؛ Mikel, Charles؛ Almazan, Perla؛ Latyshev, Sergey (01 يونيو 2010)، "An evaluation of the diagnostic accuracy of liquid chromatography-tandem mass spectrometry versus immunoassay drug testing in pain patients"، Pain Physician، 13 (3): 273–281، PMID 20495592، مؤرشف من الأصل في 8 أغسطس 2020.
- Tsai, I.-Lin؛ Weng, Te-I.؛ Tseng, Yufeng J.؛ Tan, Happy Kuy-Lok؛ Sun, Hsiao-Ju؛ Kuo, Ching-Hua (01 ديسمبر 2013)، "Screening and confirmation of 62 drugs of abuse and metabolites in urine by ultra-high-performance liquid chromatography-quadrupole time-of-flight mass spectrometry"، Journal of Analytical Toxicology، 37 (9): 642–651، doi:10.1093/jat/bkt083، PMID 24084874.
- Weinmann, W.؛ Renz, M.؛ Vogt, S.؛ Pollak, S. (01 يناير 2000)، "Automated solid-phase extraction and two-step derivatisation for simultaneous analysis of basic illicit drugs in serum by GC/MS"، International Journal of Legal Medicine، 113 (4): 229–235، doi:10.1007/s004149900098، PMID 10929239.
- Kolmonen, Marjo؛ Leinonen, Antti؛ Pelander, Anna؛ Ojanperä, Ilkka (28 فبراير 2007)، "A general screening method for doping agents in human urine by solid phase extraction and liquid chromatography/time-of-flight mass spectrometry"، Analytica Chimica Acta، 585 (1): 94–102، doi:10.1016/j.aca.2006.12.028، PMID 17386652.
- Pelander, Anna؛ Ojanperä, Ilkka؛ Laks, Suvi؛ Rasanen, Ilpo؛ Vuori, Erkki (01 نوفمبر 2003)، "Toxicological screening with formula-based metabolite identification by liquid chromatography/time-of-flight mass spectrometry"، Analytical Chemistry، 75 (21): 5710–5718، doi:10.1021/ac030162o، PMID 14588010.
- Nobilis, Milan؛ Pour, Milan؛ Senel, Petr؛ Pavlík, Jan؛ Kunes, Jirí؛ Voprsalová, Marie؛ Kolárová, Lenka؛ Holcapek, Michal (15 يونيو 2007)، "Metabolic profiling of a potential antifungal drug, 3-(4-bromophenyl)-5-acetoxymethyl-2,5-dihydrofuran-2-one, in mouse urine using high-performance liquid chromatography with UV photodiode-array and mass spectrometric detection"، Journal of Chromatography B، 853 (1–2): 10–19، doi:10.1016/j.jchromb.2007.02.045، PMID 17400036.
- Sundström, Mira؛ Pelander, Anna؛ Angerer, Verena؛ Hutter, Melanie؛ Kneisel, Stefan؛ Ojanperä, Ilkka (01 أكتوبر 2013)، "A high-sensitivity ultra-high performance liquid chromatography/high-resolution time-of-flight mass spectrometry (UHPLC-HR-TOFMS) method for screening synthetic cannabinoids and other drugs of abuse in urine"، Analytical and Bioanalytical Chemistry، 405 (26): 8463–8474، doi:10.1007/s00216-013-7272-8، PMID 23954996.
- Zahedi Rad, Maliheh؛ Neyestani, Tirang Reza؛ Nikooyeh, Bahareh؛ Shariatzadeh, Nastaran؛ Kalayi, Ali؛ Khalaji, Niloufar؛ Gharavi, Azam (01 يناير 2015)، "Competitive Protein-binding assay-based Enzyme-immunoassay Method, Compared to High-pressure Liquid Chromatography, Has a Very Lower Diagnostic Value to Detect Vitamin D Deficiency in 9–12 Years Children"، International Journal of Preventive Medicine، 6: 67، doi:10.4103/2008-7802.161069، PMC 4542329، PMID 26330983.
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
مزيد من القراءة
* L.R Snyder، J.J. كيركلاند ، وجيه دبليو دولان ، مقدمة في الكروماتوغرافيا السائلة الحديثة ، جون وايلي وأولاده ، نيويورك ، 2009. * M.W. Dong ، HPLC الحديث للعلماء الممارسين. وايلي ، 2006. * L.R Snyder، J.J. كيركلاند ، وجيه إل جلاج ، تطوير طريقة HPLC العملية ، جون وايلي وأولاده ، نيويورك ، 1997. * S. Ahuja and H. T. Rasmussen (ed)، HPLC Method Development for Pharmaceuticals، Academic Press، 2007. * S. Ahuja and MW Dong (محرر)، دليل التحليل الصيدلاني بواسطة HPLC ، Elsevier / Academic Press ، 2005. * Y. V. Kazakevich and R. LoBrutto (ed.)، HPLC for Pharmaceutical Scientists، Wiley، 2007. * U. D. Neue ، أعمدة HPLC: النظرية ، والتكنولوجيا ، والممارسة ، Wiley-VCH ، نيويورك ، 1997. * M.C McMaster، HPLC، دليل مستخدم عملي، Wiley، 2007.