القياس الطيفي الكتلي
القياس الطيفي الكتلي، (بالإنجليزية: Tandem mass spectrometry) المعروف أيضا باسم (MS/MS أو MS2)، هو تقنية تستخدم في التحليل الفعال حيث يتم الجمع بين اثنين أو أكثر من أجهزة التحليل الكتلي معا باستخدام خطوة رد فعل إضافية لزيادة قدراتهم على تحليل العينات الكيميائية.[1]
الاستخدام الشائع للرادف-MS هو تحليل الجزيئات الحيوية، مثل البروتينات والببتيدات.
جزيئات عينة معينة يجب ان تكون لمؤينة اولا ثم يتم فصل هذه الجزيئات بواسطت المطياف الأول (MS1 المعينة)، يفصل هذه الأيونات بنسبة كتلة إلى شحنة (غالبا ما تعطى على أنها م / ض أو م / س). يتم اختيار أيونات نسبة m/z معينة قادمة من MS1 ثم يتم تحويلها إلى أيونات أصغر جزء، على سبيل المثال عن طريق الانفصام الناجم عن الاصطدام، أو تفاعل الجزيئات الأيونية، أو الدمج الضوئي. ثم يتم إدخال هذه الشظايا في مطياف الكتلة الثانية (MS2)، الذي بدوره يفصل الشظايا بنسبة m/z الخاصة بهم ويكتشفها. خطوة التشظي تجعل من الممكن تحديد وفصل الأيونات التي لديها نسب m/z متشابهة جداً في مطياف الكتلة العادية.
البنية
يشمل قياس الطيف الكتلي الثلاثي رباعي الروبولي (qqq) ، رباعية وقت الطيران (Q-tof)، ومطياف الكتلة الهجين.
مطياف كتلة رباعية الروبولي الثلاثي (QQQ)
تستخدم مطياف الكتلة الرباعية الثلاثية رباعية الروبولات الأولى والثالثة كمرشحات كتلة. عندما تمر التحليلات في رباعية الروبول الثاني، التفتت يستمرّ من خلال الصطدام مع غاز. عادة ما تستخدم لصناعة الأدوية.
كواربولي وقت الرحلة (Q-tof)
Link to original page
يجمع مطياف الكتلة Q-tof بين أدوات TOF و رباعية الروبول c، والتي تسبب دقة الكتلة العالية للأيونات المنتج، والقدرة على الكميات الدقيقة، وقابلية تطبيق تجربة التشظي. هذه طريقة لقياس الطيف الكتلي تحدد نسبة تجزئة الأيونات (m/z) خلال وقت قياس الطيران.
مطياف الكتلة الهجين
يتكون مطياف الكتلة الهجين من أكثر من جهازي تحليل كتلة.
أجهزة قياس
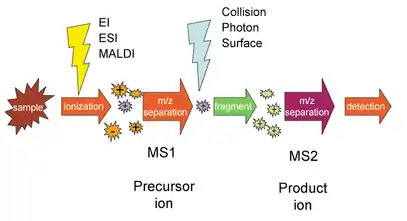
يمكن إنجاز مراحل متعددة من فصل التحليل الشامل مع عناصر مطياف الكتلة الفردية المنفصلة في الفضاء أو باستخدام مطياف كتلة واحدة مع خطوات MS مفصولة في الوقت المناسب. بالنسبة لقياس الطيف الكتلي في الفضاء، غالباً ما يتم ملاحظة العناصر المختلفة في الاختزال، مما يعطي نوع محدد الكتلة المستخدم.
الترادف في الفضاء
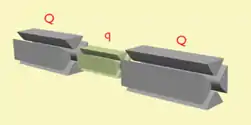
في قياس الطيف الكتلي في الفضاء، يتم فصل عناصر الفصل مادياً ومتميزة، على الرغم من وجود اتصال مادي بين العناصر للحفاظ على الفراغ العالي. ويمكن أن تكون هذه العناصر قطاعات، ناقل الحركة رباعية، أو وقت الطيران. عند استخدام رباعية الروبول متعددة، فإنها يمكن أن تعمل على حد سواء التحليلات الشامل وغرف الاصطدام.
ونُوّج شائع للتحليلات الشامل (analyzer) – الكتلة الرباعية Q; س – تردد الراديو اصطدام رباعية; TOF – محلل كتلة وقت الطيران؛ ب – القطاع المغناطيسي، و E – قطاع الكهرباء. ويمكن الجمع بين هذا الوَصَن للإشارة إلى مختلف الأدوات الهجينة، على سبيل المثال QqQ ' – مطياف كتلة رباعية رباعية ثلاثية؛ QTOF – رباعية الوقت من الطيران مطياف كتلة (أيضا QqTOF); وBEBE - أربعة قطاعات (الهندسة العكسية) مطياف الكتلة.
الترادف في الزمان
من خلال القيام بالتماثل الطيفي الكتلي في الوقت المناسب، يتم إنجاز الفصل مع الأيونات المحاصرين في نفس المكان، مع خطوات فصل متعددة تجري بمرور الوقت. ويمكن استخدام أيون رباعي أو فورييه تحويل الرنين السيكترون (FTICR) ل هذا التحليل. يمكن لأدوات التراكب أداء خطوات متعددة من التحليل، والتي يشار إليها أحيانًا باسم (MSn )(MS إلى n)غالباً لا يتم الإشارة إلى عدد الخطوات، n، ولكن في بعض الأحيان يتم تحديد القيمة؛ على سبيل المثال يشير MS3 ثلاث مراحل من الانفصال.[2] جنبا إلى جنب في الوقت أجهزة MS لا تستخدم وسائط وصفها بعد ذلك، ولكن عادة جمع كل المعلومات من السلائف مسح الأيونات ومسح أيون الأصل من الطيف بأكمله. كل تكوين مفيدة يستخدم طريقة فريدة من نوعها من تحديد الشامل.
الترادف في الفضاء وسائط MS / MS
عندما يتم تنفيذ MS جنبا إلى جنب مع تصميم في الفضاء، يجب أن تعمل في صك واحد من مجموعة متنوعة من وسائط. هناك عدد من مختلف الاجهزة ترادف MS / MS التجريبية ولكل وضع تطبيقاتها الخاصة ويوفر معلومات مختلفة. يستخدم نظام MS في الفضاء اقتران مكونين من أجهزة القياس التي تقيس نفس نطاق الطيف الكتلي ولكن مع تجزئة متحكم فيها بينهما في الفضاء، بينما ينطوي التصلب المتعدد جنباً إلى جنب في الوقت المناسب على استخدام مصيدة أيونية.

هناك أربع تجارب المسح الرئيسية الممكنة باستخدام MS / MS: السلائف مسح الأيونات، مسح أيون المنتج، مسح الخسارة محايدة، ورصد رد فعل مختارة.
بالنسبة لمسح أيونات السلائف، يتم اختيار أيون المنتج في محلل الكتلة الثاني، ويتم مسح الكتل الأولية في محلل الكتلة الأول. لاحظ أنّ [السلائف] أيون مرادفة مع أصل أيون وننتج مع ابنة أيون مهما الاستعمال من هذا [أنثروبومورسم] شروط يكون غير مشجع.[3]
في أيون المنتج المسح الضوئي، يتم اختيار أيون السلائف في المرحلة الأولى، ويسمح لتجزئة ومن ثم يتم مسح جميع الجماهير الناتجة في محلل كتلة الثانية والكشف في كاشف التي يتم وضعها بعد محلل كتلة الثانية. عادة ما يتم تنفيذ هذه التجربة لتحديد التحولات المستخدمة في القياس الكمي بواسطة MS جنبا إلى جنب.
في مسح خسارة محايدة، يقوم محلل الكتلة الأول بمسح جميع الكتل. يقوم محلل الكتلة الثانية أيضا بالمسح، ولكن في إزاحة مجموعة من محلل كتلة الأولى.[4] يتوافق هذا الإزاحة مع خسارة محايدة لوحظت عادةً لفئة المركبات. في فحص الخسارة المستمرة المحايدة، يتم رصد جميع السلائف التي تخضع لفقدان محايد مشترك محدد. للحصول على هذه المعلومات، يتم مسح كلا التحليلات الكتلة في وقت واحد، ولكن مع إزاحة الكتلة التي ترتبط مع كتلة المحايد المحدد. وعلى غرار المسح الضوئي للسلائف الأيونات، تفيد هذه التقنية أيضا في التحديد الانتقائي لفئة المركبات ذات الصلة الوثيقة في الخليط.
في مراقبة التفاعل المحدد، يتم تعيين كل من المحللين الشاملين إلى كتلة مختارة. هذا الوضع مشابه لمراقبة أيونات مختارة لتجارب التصلب العصبي المتعدد. وضع تحليل انتقائي، والذي يمكن أن يزيد من الحساسية.[5]
التجزئة
تجزئة أيونات مرحلة الغاز أمر ضروري لقياس الطيف الكتلي جنبا إلى جنب ويحدث بين مراحل مختلفة من التحليل الشامل. هناك العديد من الطرق المستخدمة لتفتيت الأيونات وهذه يمكن أن تؤدي إلى أنواع مختلفة من التشرذم وبالتالي معلومات مختلفة حول بنية وتكوين الجزيء.
التجزئة في المصدر
غالبا، عملية التأين يكون بما فيه الكفاية عنيفة أن يترك الأيونات الناتجة مع طاقة داخلية كافية لتفتيت داخل مطياف الكتلة. إذا استمرت أيونات المنتجات في حالة عدم التوازن لفترة معتدلة من الوقت قبل تفكك تلقائيًا، تسمى هذه العملية تجزئة الفوقا.[6] يشير تجزئة المكتشطة الفوهة إلى الحث الهادف للتجزئة في المصدر عن طريق زيادة إمكانات المكتشطة الفوهة على الأدوات القائمة على الرذاذ الكهربائي عادة. على الرغم من أن التجزئة في المصدر تسمح لتحليل التجزئة، فإنه ليس من الناحية الفنية قياس الطيف الكتلي الترادفي إلا إذا تم تحليل كتلة الأيونات (مؤقت الاستقرار:metastable) أو اختيار قبل تفكك تلقائي ويتم تنفيذ المرحلة الثانية من التحليل على الأجزاء الناتجة. غالباً ما يستخدم التجزئة في المصدر بالإضافة إلى قياس الطيف الكتلي جنباً إلى جنب (مع تجزئة ما بعد المصدر) للسماح بخطوتين من التشظي في نوع MS3 زائف من التجربة.[7]
الانفصام الناجم عن التحلل
تجزئة ما بعد المصدر هو في معظم الأحيان ما يتم استخدامه في تجربة قياس الطيف الكتلي جنبا إلى جنب. ويمكن أيضا أن تضاف الطاقة إلى الأيونات، التي عادة ما تكون متحمسة بالفعل اهتزازي، من خلال الاصطدامات بعد المصدر مع ذرات أو جزيئات محايدة، وامتصاص الإشعاع، أو نقل أو التقاط الإلكترون من قبل أيون مشحونة مضاعفة. ينطوي الانفصام الناجم عن الاصطدام (CID)، الذي يسمى أيضًا بالتفكك المنشط بشكل تصادمي (CAD)، على اصطدام أيون بذرة محايدة أو جزيء في مرحلة الغاز والتفكك اللاحق للايون.[8] على سبيل المثال، ضع في اعتبارك:
حيث أيون AB + يصطدم مع الأنواع المحايدة M وينهار في وقت لاحق. يتم وصف تفاصيل هذه العملية من خلال نظرية الاصطدام. ونظراً لاعتراض اختلاف في التكوين، يمكن أن يكون هناك نوعان رئيسيان مختلفان من الـ CID: '1' نوع الشعاع (حيث تكون الأيونات السليفة مجزأة أثناء الطيران) و(2) من نوع مصيدة الأيونات (حيث تكون الأيونات السليفة محصورة أولاً ثم تُجزت).[9][10]
وهناك نوع ثالث وأكثر حداثة من تجزئة CID هو انفصام تصادمي عالي الطاقة (HCD). (HCD) هو تقنية CID محددة لمطياف كتلة المدار الذي يحدث تجزئة خارج فخ أيون، [11] يحدث ذلك في خلية HCD (في بعض الأدوات المسماة "أيون توجيهmultipole HCDهو تجزئة من نوع التراكب الذي تبين أن له خصائص من نوع الحزم.[12]
طرق التقاط ونقل الإلكترونات
الطاقة التي يتم إطلاقها عند نقل إلكترون أو التقاطه بواسطة أيون مشحون مضاعفة يمكن أن تحفز التشظي.
الإلكترون التقاط تفكك
إذا تم إضافة إلكترون إلى أيون موجب مشحون، يتم تحرير طاقة كولوم. إضافة الإلكترون الحر يسمى الايكتر القبض على الانفصام (ECD) ويمثلها:
لمضاعفة جزيء مبروتز.
نقل الإلكترون تفكك
ويسمى إضافة إلكترون من خلال أيونات تفاعل انفصام نقل الإلكترون (ETD). على غرار الانفصام في التقاط الإلكترونات، يؤدي ETD إلى تفتيت الكاتيونات (مثل الببتيدات أو البروتينات) عن طريق نقل الإلكترونات إليها. اخترعه دونالد ف. هانت، جوشوا كون، جون إ. ب. سيكا وجارود مارتو في جامعة فرجينيا.[13]
لا تستخدم ETD الإلكترونات الحرة ولكنها تستخدم الأنيونات الجذرية (مثل الجمرة الخبيثة أو الأزوزبينزين) لهذا الغرض:
حيث A هو anion.
تَدَمّر بشكل عشوائي على طول العمود الفقري الببتيد (ج وإيونات z) بينما تُترك السلاسل الجانبية والتعديلات مثل الفوسفور سليمة. هذه التقنية تعمل بشكل جيد فقط للأيونات الدولة تهمة أعلى (z>2)، ولكن بالنسبة إلى تفكك الناجم عن الاصطدام (CID)، ETD مفيد لتفتيت الببتيدات أطول أو حتى البروتينات بأكملها. وهذا يجعل هذه التقنية مهمة لبروتيوميكس من أعلى إلى أسفل. مثل الكثير من النماء في مرحلة الطفولة المبكرة، ETD فعالة للببتيدات مع تعديلات مثل الفوسفور.[14]
نقل الإلكترون وتفكك الاصطدام العالي الطاقة (EThcD) هو مزيج ETD وHCD حيث يتم إخضاع السلائف الببتيد في البداية إلى تفاعل أيونات أيونات الفلورانثين في فخ أيونات خطية، والذي يولد c - و z -ions] ] في الخطوة الثانية يتم تطبيق تجزئة HCD جميع الأيونات على جميع الأيونات المشتقة من ETD لتوليد الأيونات b- و y- قبل التحليل النهائي في محلل الارمدى.[11] تستخدم هذه الطريقة التجزئة المزدوجة لتوليد أيونات وبالتالي أطياف MS/MS الغنية بالبيانات لتسلسل الببتيد وتوطين PTM.
عزل نقل الإلكترونات السالبة
ويمكن أن يحدث التجزؤ أيضاً مع أنواع غير مُتَجَرَّعة، حيث يتم نقل الإلكترون من الأنواع إلى كاشفات الموجبة في انفصال نقل الإلكترونات السالب (NETD)
بعد هذا الحدث نقل، الإلكترون نقص anion يخضع لإعادة ترتيب داخلي وشظايا. NETD هو التماثلية أيون/أيون من انفصال الإلكترون (EDD).
NETD متوافق مع تفتيت الببتيد والبروتينات على طول العمود الفقري في السندات Cα-C. الشظايا الناتجة عادة ما تكون أيونات من نوع المنتج أو أيونات من نوع x.[15]
انفصال الإلكترون
انفصال الإلكترون (EDD) هو طريقة لتفتيت الأنواع الأيونية في قياس الطيف الكتلي. وهو بمثابة وضع مضاد سلبي لإمساك الإلكترونات بالانفصام. يتم تنشيط الأيونات المشحونة بشكل سلبي عن طريق التشعيع مع إلكترونات الطاقة الحركية المعتدلة. والنتيجة هي طرد الإلكترونات من الجزيء الأيوني الأم، الذي يسبب التفكك عن طريق إعادة التركيب.
عزل نقل الشحن
رد فعل بين الببتيدات المشحونة بشكل إيجابي والكواشف الموجبة، المعروف أيضا باسم انفصال نقل الشحن (CTD)،وقد ثبت مؤخرا كمسار تفتيت الطاقة العالية البديلة لحالة منخفضة الشحن (1 + أو 2 +) الببتيدات. الآلية المقترحة من CTD باستخدام الهيليوم الكاتيون كما الكاشف هو:
التقارير الأولية هي أن CTD يسبب العمود الفقري Cα-C انشقاق السندات من الببتيدات ويوفر أيونات المنتج من نوع a- و x
الاعوض الضوئي
يمكن إضافة الطاقة المطلوبة للتفكك عن طريق امتصاص الفوتون، مما يؤدي إلى الصورة الأيونية ويمثلها:
حيث يمثل hv الفوتون الممتص بواسطة الأيون. يمكن استخدام أشعة الليزر فوق البنفسجية، ولكن يمكن أن يؤدي إلى تفتيت مفرط للجزيئات الحيوية.
تفكك متعدد الصور بالأشعة تحت الحمراء
سوف الفوتونات تحت الحمراء تسخين الأيونات ويسبب تفكك إذا تم امتصاص ما يكفي منها. وتسمى هذه العملية تفكك متعدد الصور بالأشعة تحت الحمراء (IRMPD) وغالبا ما يتم إنجازها مع ليزر ثاني أكسيد الكربون ومطياف كتلة المحاصرة أيون مثل FTMS.
تفكك بلاكبودي الأشعة تحت الحمراء
يمكن استخدام إشعاع الجسم الأسود في التصوير الضوئي في تقنية تعرف باسم الانفصام الإشعاعي بالأشعة تحت الحمراء (BIRD). في طريقة BIRD، يتم تسخين غرفة فراغ الطيف الشامل بأكملها لإنشاء ضوء الأشعة تحت الحمراء. يستخدم BIRD هذا الإشعاع لإثارة الاهتزازات المتزايدة النشاط للأيونات، حتى ينكسر السندات، وخلق شظايا. هذا مشابه للفصّل متعدد الصور بالأشعة تحت الحمراء والذي يستخدم أيضًا ضوء الأشعة تحت الحمراء، ولكن من مصدر مختلف. وغالبا ما يستخدم الطيور مع فورييه تحويل ايونات السيكلوترون الرنين الطيفي الكتلة.
الانفصام المستحث السطحي
مع الانفصام الناجم عن السطح (SID)، التجزئة نتيجة اصطدام أيون مع سطح تحت فراغ عال. اليوم، يتم استخدام SID لتجزئة مجموعة واسعة من الأيونات. قبل سنوات، كان من الشائع فقط لاستخدام SID على كتلة أقل، الأنواع المشحونة بشكل وحيد لأن أساليب التأين وتقنيات محللات الكتلة لم تكن متقدمة بما يكفي لتشكيل بشكل صحيح، ونقل، أو تميز أيونات من ارتفاع م / ض. مع مرور الوقت، كانت الأسطح أحادية الطبقات ذاتية التجميع (SAMs) المكونة من CF3 (CF2) 10CH2CH2S على الذهب هي أبرز أسطح التصادم المستخدمة في SID في مطياف جنبا إلى جنب. وقد عملت نظم الصوامات (SAMs) كأهداف اصطدامية مرغوبة أكثر بسبب كتلها الفعالة الكبيرة المميزة لتصادم الأيونات الواردة. بالإضافة إلى ذلك، تتكون هذه الأسطح من سلاسل فلورية صلبة، والتي لا تضعف بشكل كبير طاقة أيونات المقذوفات. سلاسل الفلوروكربون هي أيضا مفيدة بسبب قدرتها على مقاومة نقل الإلكترونات السهل من سطح المعدن إلى الأيونات الواردة. قدرة SID على إنتاج التراكبات الفرعية التي تبقى ثابتة وتوفر معلومات قيمة عن الاتصال لا مثيل لها من قبل أي تقنية انفصال أخرى. وبما أن المجمعات المنتجة من SID مستقرة وتحتفظ بتوزيع الشحن على الجزء، فإن هذا ينتج أطياف فريدة من نوعها، والتي يتركز فيها المجمع حول توزيع أضيق m / z. منتجات SID والطاقة التي تشكل هي تعكس نقاط القوة والطبولوجيا من المجمع. تساعد أنماط الانفصام الفريدة في اكتشاف الهيكل الرباعي للمجمع. توزيع تهمة متماثل والتبعية تفكك هي فريدة من نوعها ل SID وجعل الأطياف المنتجة مميزة من أي تقنية تفكك أخرى.
تقنية SID أيضاً قابلة للتطبيق على قياس الطيف الكتلي الكتلي (IM-MS) الحركة الأيونية. ثلاث طرق مختلفة لهذه التقنية تشمل تحليل توصيف الطوبولوجيا، والاتصال بين االبونيت، ودرجة تتكشف لبنية البروتين. تحليل بنية البروتين تتكشف هو التطبيق الأكثر استخداما لتقنية SID. لقياس الطيف الكتلي لأيونات الحركة (IM-MS)، يستخدم SID للتفكك من السلائف المصدر المنشطة لثلاثة أنواع مختلفة من مجمعات البروتين: بروتين C-reactive (CRP)، transthyretin (TTR)، والكونثانانافالين A (Con A). يتم استخدام هذا الأسلوب لمراقبة درجة تتكشف لكل من هذه المجمعات. لهذه الملاحظة، أظهرت SID هياكل الأيونات السلائف الموجودة قبل الاصطدام مع السطح. IM-MS يستخدم SID كمقياس مباشر للتشكل لكل من الوحدات الفرعية البروتينات.
فورييه تحويل الرنين السيكلوترون (FTICR) قادرة على توفير دقة فائقة وعالية الدقة الكتلة للأجهزة التي تأخذ قياسات الكتلة. هذه الميزات تجعل مطياف كتلة FTICR أداة مفيدة لمجموعة واسعة من التطبيقات مثل عدة تجارب تفكك[44] مثل الانفصام الناجم عن الاصطدام (CID، انفصال نقل الإلكترون (ETD)، وغيرها. وبالإضافة إلى ذلك، تم تنفيذ الانفصام الناجم عن السطح مع هذا الصك لدراسة تفتيت الببتيد الأساسي. وعلى وجه التحديد، تم تطبيق SID على دراسة العوامل النشطة وحركية تجزئة مرحلة الغاز داخل أداة [ICR] وقد استخدم هذا النهج لفهم تجزئة مرحلة الغاز من الببتيدات البروتينية، أيونات الببتيدات الإلكترونية الغريبة، غير التكافؤ يغاند-ببتيد المجمعات، ومجموعات المعادن.
البروتيوميات الكمية
يستخدم البروتين الكمي لتحديد الكمية النسبية أو المطلقة من البروتينات في العينة. تعتمد عدة طرق بروتومية كميّة على قياس الطيف الكتلي جنباً إلى جنب. وقد أصبح MS /MS إجراءً معيارياً لجلاء هيكلي للجزيئات الحيوية المعقدة.
طريقة واحدة تستخدم عادة للبروتيوميات الكمية هو وضع العلامات التساوية. علامة الـ Isobaric وسم يتيح تحديد وتكميم البروتينات في وقت واحد من عينات متعددة في تحليل واحد. ولتحديد كمية البروتينات، تحمل الببتيدات علامات كيميائية لها نفس الهيكل والكتلة الاسمية، ولكنها تختلف في توزيع النظائر الثقيلة في بنيتها. هذه العلامات، التي يشار إليها عادة باسم العلامات كتلة جنبا إلى جنب، مصممة بحيث يتم شق العلامة الشامل في منطقة رابط محددة على أعلى الطاقة الناجمة عن تفكك الاصطدام (HCD) خلال قياس الطيف الشامل جنبا إلى جنب تسفر عن أيونات مراسل من الجماهير المختلفة. يتم إنجاز كمية البروتين من خلال مقارنة شدة أيونات المراسل في أطياف MS/MS. اثنين من العلامات isobaric المتاحة تجاريا هي iTRAQ والكواشف TMT.
علامات متساوية الضغط للكمية النسبية والمطلقة (iTRAQ)
علامة تساوي الضغط بين الزوارق للكمية النسبية والمطلقة (iTRAQ) هي كاشف لقياس الطيف الكتلي المرادف الذي يستخدم لتحديد كمية البروتينات من مصادر مختلفة في تجربة واحدة. ويستخدم النظائر المستقرة الجزيئات المسماة التي يمكن أن تشكل رابطة تعايشية مع N-terminus وسلسلة جانبية من البروتينات. وتستخدم الكواشف iTRAQ لتسمية الببتيدات من عينات مختلفة التي يتم تجميعها وتحليلها بواسطة الكروماتوغرافيا السائلة وقياس الطيف الكتلي جنبا إلى جنب. تجزئة العلامة المرفقة يولد أيون مراسل كتلة الجزيئية منخفضة التي يمكن استخدامها لتحديد كمية نسبيا الببتيدات والبروتينات التي نشأت منها.
علامة كتلة الترادف (TMT)
علامة كتلة الترادف (TMT) هو تسمية كيميائية العلامة كتلة متساوية الضغط المستخدمة لتحديد الكم البروتين وتحديد. [54] تحتوي العلامات على أربع مناطق: المراسل الشامل، رابط قابل للشق، تطبيع الكتلة، ومجموعة البروتين التفاعلي. يمكن استخدام الكواشف TMT لتحليل 2 إلى 11 عينة ببتيد مختلفة في وقت واحد أعدت من الخلايا والأنسجة أو السوائل البيولوجية. ثلاثة أنواع من الكواشف TMT متوفرة مع عمليات إعادة تنشيط كيميائية مختلفة: (1) مجموعة وظيفية NHS استر التفاعلية لوضع العلامات الأمينات الأولية (TMTduplex، TMTsixplex، TMT10plex بالإضافة TMT11-131C)، (2) مجموعة وظيفية iodoacetyl التفاعلية لوضع العلامات على السلفهيدريل مجانا (iodoTMT) و (3) مجموعة وظيفية ألكوسيامين التفاعلية لوضع العلامات من الكربونيات (aminoxyTMT).
التطبيقات
الببتيدات
يمكن استخدام قياس الطيف الكتلي جنبا إلى جنب لتسلسل البروتين.عندما يتم إدخال البروتينات سليمة إلى محلل كتلة، وهذا ما يسمى "من أعلى إلى أسفل البروتيوميكس" وعندما يتم هضم البروتينات في الببتيدات أصغر وأدخل في وقت لاحق في مطياف الشامل، وهذا ما يسمى "من أسفل إلى أعلى البروتينات". البروتيوميات بندقية هو البديل من أسفل حتى البروتيوميات التي يتم هضم البروتينات في خليط قبل فصل وقياس الطيف الكتلي جنبا إلى جنب.
يمكن أن تنتج قياس الطيف الكتلي جنبا إلى جنب علامة تسلسل الببتيد التي يمكن استخدامها لتحديد الببتيد في قاعدة بيانات البروتين. وقد تم وضع إشارة للإشارة إلى شظايا الببتيد التي تنشأ من طيف كتلة جنبا إلى جنب. [ يشار إلى أيونات شظية الببتيد بواسطة a أو b أو c إذا تم الاحتفاظ بالتهمة على الـ N-terminus و x أو y أو z إذا تم الاحتفاظ بالتهمة على الـ C-terminus. يشير هذا الوسم إلى عدد بقايا الأحماض الأمينية في الجزء. وتستخدم في بعض الأحيان الأوصاف للإشارة إلى الخسائر المحايدة بالإضافة إلى تجزئة العمود الفقري، * لفقدان الأمونيا و° لفقدان المياه. على الرغم من أن شق العمود الفقري الببتيد هو الأكثر فائدة لتسلسل وتحديد الببتيد يمكن ملاحظة أيونات جزء أخرى في ظل ظروف انفصام الطاقة العالية. وتشمل هذه الأيونات الجانبية خسارة سلسلة د، V، ث والأيونات الأمونيوم وأيونات جزء إضافية تسلسل محددة المرتبطة بمخلفات معينة من الأحماض الأمينية.[16]
أوليغوساكاريدس
قد يتم تسلسل Oligosaccharides باستخدام قياس الطيف الكتلي جنبا إلى جنب بطريقة مماثلة لتسلسل الببتيد. يحدث التجزؤ بشكل عام على جانبي السندات الغليكوسية (ب، ج، ص، أيونات z) ولكن أيضا في ظروف أكثر حيوية من خلال هيكل حلقة السكر في شق عبر حلقة (x الأيونات). مرة أخرى تستخدم subscripts زائدة للإشارة إلى موضع الانقسام على طول السلسلة. بالنسبة لأيونات شق حلقة عبر يشار إلى طبيعة الانقسام عبر حلقة من قبل الفوقية السابقة.
أوليغونوكليوتيدات
وقد تم تطبيق قياس الطيف الكتلي جنبا إلى جنب على تسلسل الحمض النووي والحمض النووي الريبي. وقد اقترح اَن ينقّط على تجزئة مرحلة الغاز للأيونات القلوينوية.
فحص حديثي الولادة
فحص حديثي الولادة هو عملية اختبار الأطفال حديثي الولادة للأمراض الوراثية، والأمراض التنانائية، والتمثيلية، والهماكتولوجية القابلة للعلاج. أدى تطور فحص القياس الطيفي الكتلي في أوائل التسعينيات إلى توسع كبير في أمراض التمثيل الغذائي الخلقية التي يمكن اكتشافها والتي تؤثر على مستويات الدم من الأحماض العضوية.
الحد
لا يمكن تطبيق قياس الطيف الكتلي جنباً إلى جنب على تحليلات الخلية المفردة لأنها غير حساسة لتحليل هذه الكميات الصغيرة من الخلية. القيود على هذه العبوات ترجع في المقام الأول إلى مزيج من عدم كفاءة إنتاج الأيونات والخسائر الأيونية داخل الأدوات بسبب مصادر الضوضاء الكيميائية للمذيبات.
التوقعات المستقبلية
وسوف يكون قياس الطيف الكتلي جنبا إلى جنب أداة مفيدة لتوصيف البروتين، ومجمعات البروتينات النووية، وغيرها من الهياكل البيولوجية. ومع ذلك، تركت بعض التحديات مثل تحليل توصيف البروتيم من الناحيتيّن كماً ونوعاً.
المراجع
- "IUPAC - tandem mass spectrometer (T06250)"، goldbook.iupac.org، مؤرشف من الأصل في 30 يناير 2020، اطلع عليه بتاريخ 11 سبتمبر 2020.
- Cody, R. B.؛ Freiser, B. S. (01 يناير 1982)، "Collision-induced dissociation in a fourier-transform mass spectrometer"، International Journal of Mass Spectrometry and Ion Physics (باللغة الإنجليزية)، 41 (3): 199–204، doi:10.1016/0020-7381(82)85035-3، ISSN 0020-7381، مؤرشف من الأصل في 11 سبتمبر 2020.
- Bursey, Maurice M. (1991)، "Comment to readers: Style and the lack of it"، Mass Spectrometry Reviews (باللغة الإنجليزية)، 10 (1): 1–2، doi:10.1002/mas.1280100102، ISSN 1098-2787، مؤرشف من الأصل في 06 يونيو 2020.
- Louris, John N.؛ Wright, Larry G.؛ Cooks, R. Graham.؛ Schoen, Alan E. (01 ديسمبر 1985)، "New scan modes accessed with a hybrid mass spectrometer"، Analytical Chemistry، 57 (14): 2918–2924، doi:10.1021/ac00291a039، ISSN 0003-2700، مؤرشف من الأصل في 11 سبتمبر 2020.
- Edmond de؛ Stroobant, Vincent (17 أكتوبر 2001)، Mass Spectrometry: Principles and Applications (باللغة الإنجليزية)، Wiley، ISBN 978-0-471-48566-7، مؤرشف من الأصل في 11 سبتمبر 2020.
- "IUPAC - transient (chemical) species (T06451)"، goldbook.iupac.org، مؤرشف من الأصل في 20 يناير 2020، اطلع عليه بتاريخ 11 سبتمبر 2020.
- Körner, R.؛ Wilm, M.؛ Morand, K.؛ Schubert, M.؛ Mann, M. (1996-02)، "Nano electrospray combined with a quadrupole ion trap for the analysis of peptides and protein digests"، Journal of the American Society for Mass Spectrometry، 7 (2): 150–156، doi:10.1016/1044-0305(95)00626-5، ISSN 1044-0305، PMID 24203235، مؤرشف من الأصل في 11 سبتمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Sleno, Lekha؛ Volmer, Dietrich A. (2004)، "Ion activation methods for tandem mass spectrometry"، Journal of Mass Spectrometry (باللغة الإنجليزية)، 39 (10): 1091–1112، doi:10.1002/jms.703، ISSN 1096-9888، مؤرشف من الأصل في 11 سبتمبر 2020.
- Bantscheff, Marcus؛ Boesche, Markus؛ Eberhard, Dirk؛ Matthieson, Toby؛ Sweetman, Gavain؛ Kuster, Bernhard (01 سبتمبر 2008)، "Robust and Sensitive iTRAQ Quantification on an LTQ Orbitrap Mass Spectrometer"، Molecular & Cellular Proteomics (باللغة الإنجليزية)، 7 (9): 1702–1713، doi:10.1074/mcp.M800029-MCP200، ISSN 1535-9476، PMID 18511480، مؤرشف من الأصل في 05 فبراير 2019.
- March, Raymond E. (1997)، <351::AID-JMS512>3.0.CO;2-Y "An Introduction to Quadrupole Ion Trap Mass Spectrometry"، Journal of Mass Spectrometry (باللغة الإنجليزية)، 32 (4): 351–369، doi:10.1002/(SICI)1096-9888(199704)32:43.0.CO;2-Y، ISSN 1096-9888، مؤرشف من الأصل في 16 يونيو 2020.
- Olsen, Jesper V.؛ Macek, Boris؛ Lange, Oliver؛ Makarov, Alexander؛ Horning, Stevan؛ Mann, Matthias (2007-09)، "Higher-energy C-trap dissociation for peptide modification analysis"، Nature Methods (باللغة الإنجليزية)، 4 (9): 709–712، doi:10.1038/nmeth1060، ISSN 1548-7105، مؤرشف من الأصل في 11 سبتمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Jora, Manasses؛ Burns, Andrew P.؛ Ross, Robert L.؛ Lobue, Peter A.؛ Zhao, Ruoxia؛ Palumbo, Cody M.؛ Beal, Peter A.؛ Addepalli, Balasubrahmanyam؛ Limbach, Patrick A. (01 أغسطس 2018)، "Differentiating Positional Isomers of Nucleoside Modifications by Higher-Energy Collisional Dissociation Mass Spectrometry (HCD MS)"، Journal of the American Society for Mass Spectrometry، 29 (8): 1745–1756، doi:10.1021/jasms.8b05892، ISSN 1044-0305، مؤرشف من الأصل في 11 سبتمبر 2020.
- Cooper, Helen J.؛ Håkansson, Kristina؛ Marshall, Alan G. (2005)، "The role of electron capture dissociation in biomolecular analysis"، Mass Spectrometry Reviews (باللغة الإنجليزية)، 24 (2): 201–222، doi:10.1002/mas.20014، ISSN 1098-2787، مؤرشف من الأصل في 06 يونيو 2020.
- Chi, An؛ Huttenhower, Curtis؛ Geer, Lewis Y.؛ Coon, Joshua J.؛ Syka, John E. P.؛ Bai, Dina L.؛ Shabanowitz, Jeffrey؛ Burke, Daniel J.؛ Troyanskaya, Olga G. (13 فبراير 2007)، "Analysis of phosphorylation sites on proteins from Saccharomyces cerevisiae by electron transfer dissociation (ETD) mass spectrometry"، Proceedings of the National Academy of Sciences (باللغة الإنجليزية)، 104 (7): 2193–2198، doi:10.1073/pnas.0607084104، ISSN 0027-8424، PMID 17287358، مؤرشف من الأصل في 16 أغسطس 2018.
- Coon, Joshua J.؛ Shabanowitz, Jeffrey؛ Hunt, Donald F.؛ Syka, John E. P. (2005-06)، "Electron transfer dissociation of peptide anions"، Journal of the American Society for Mass Spectrometry، 16 (6): 880–882، doi:10.1016/j.jasms.2005.01.015، ISSN 1044-0305، PMID 15907703، مؤرشف من الأصل في 11 سبتمبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Downard, Kevin M.؛ Biemann, Klaus (1995)، "Methionine specific sequence ions formed by the dissociation of protonated peptides at high collision energies"، Journal of Mass Spectrometry (باللغة الإنجليزية)، 30 (1): 25–32، doi:10.1002/jms.1190300106، ISSN 1096-9888، مؤرشف من الأصل في 11 سبتمبر 2020.
- بوابة طب
- بوابة الكيمياء