برمنغنات الأمونيوم
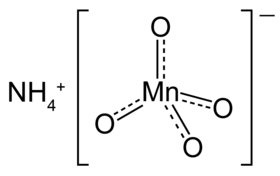
برمنغنات الأمونيوم هو مركب كيميائي يُرمز له بالصيغة الكيميائية NH4MnO4 أو NH3·HMnO4.[1][2][3] هذا المركب قابل للذوبان في الماء ويُعتبر مؤكسِد قوي بفضل أنيون البرمنغنات الموجود فيه، فضلاً عن كونه أيضاً مادة متفجرة قوية نتيجة اندماج البرمنغنات المؤكسِدة وكاتيون الأمونيوم. برمنغنات الأمونيوم الجاف يمكن أن تنفجر انفجاراً صاعقاً عن طريق تعرضه للحرارة، الاحتكاك، أو الصدمة الكهربائية. هذا ويمكن أن ينفجر أيضاً في درجة حرارة فوق ال C° 60 يتحلل برمنغنات الأمونيوم منفجراً إلى أكسيد المنغنيز الرباعي، النيتروجين، والماء. 2NH4MnO4 → 2 MnO2 + N2 + 4 H2O أول من قام بتحضير برمنغنات الأمونيوم كان العالِم الألماني إيلهارد ميتشرلك عام 1824 بواسطة التفاعل الكيميائي بين برمنغنات الفضة وكمية كتلية مساوية من كلوريد الأمونيوم، حيث يتم تصفية كلوريد الفضة وتتبخر الماء فينتج عن ذلك بقاء برمنغنات الأمونيوم.
| برمنغنات الأمونيوم | |
|---|---|
 برمنغنات الأمونيوم | |
| الاسم النظامي (IUPAC) | |
Ammonium manganate(VII) | |
| أسماء أخرى | |
Ammonium permanganate | |
| المعرفات | |
| رقم CAS | 13446-10-1 |
| بوب كيم (PubChem) | 61604 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| الصيغة الجزيئية | NH4MnO4 |
| الكتلة المولية | 136.974 غ/مول |
| المظهر | صلب بلوري قرمزي إلى بنفسجي |
| الكثافة | 2.2 غ/سم3 (صلب) |
| نقطة الانصهار | يتفكك |
| الذوبانية في الماء | 8.0 غ/100 مل عند 15 °س |
| البنية | |
| البنية البلورية | نظام بلوري معيني قائم |
| كيمياء حرارية | |
| إنتروبيا مولية قياسية S |
J.K−1.mol−1 |
| المخاطر | |
| NFPA 704 |
0
0
3
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
علاوة على ذلك يمكن تحضيره أيضاً بطريقة مشابهة بواسطة برمنغنات الباريوم وكبريتات الأمونيوم.
انظر أيضا
مراجع
- "معلومات عن برمنغنات الأمونيوم على موقع chem.nlm.nih.gov"، chem.nlm.nih.gov، مؤرشف من الأصل في 24 أكتوبر 2019.
- "معلومات عن برمنغنات الأمونيوم على موقع chemspider.com"، chemspider.com، مؤرشف من الأصل في 22 مارس 2019.
- "PASCZIGWJWZUOV-UHFFFAOYSA-O"%5bInChIKey%5d "معلومات عن برمنغنات الأمونيوم على موقع ncbi.nlm.nih.gov"، ncbi.nlm.nih.gov، مؤرشف من "PASCZIGWJWZUOV-UHFFFAOYSA-O"%5bInChIKey%5d الأصل في 26 مارس 2020.
- بوابة الكيمياء
