بيرتكنيشات
أيون بيرتكنيشات هو أوكسوانيون صيغته الكيميائية هي TcO4-. وغالبا ما يستخدم كمصدر مناسب لذوبان النظائر المشعة لعنصر التكنيشيوم (Tc) في الماء. يتم استخدامه على وجه الخصوص لنقل النظير 99mTc (عمر النصف 6 ساعات) الذي يشيع استخدامه في الطب النووي في العديد من إجراءات المسح النووي.
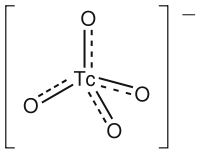
هيكل أيون تكنيشات (السابع).
تكنيشات(VII أو السابع) المالح هو مركب يحتوي على هذا الأيون. حيث أن مركبات بيرتكنيشات هي أملاح من حمض تكنيشات (VII). بيرتكنيشات يشبه برمنغنات ولكن لديه القليل من القوة المؤكسدة. بيرتكنيشات لديه قوة مؤكسدة أعلى من برهينات.[1] فهم بيرتكنيش مهم في فهم التلوث التكنيشيوم في البيئة وفي إدارة النفايات النووية.[1]
المركبات
| الصيغة | الاسم | هيكل كريستال | خلية الأبعاد Å | حجم الخلية الواحدة Å3 | ملاحظات | مراجع |
|---|---|---|---|---|---|---|
| LiTcO4 | بيرتكنيشات الليتيوم | [1] | ||||
| LiTcO4•2H2O | بيرتكنيشات الليتيوم مونوهيدراتي | [1] | ||||
| LiTcO4•3H2O | بيرتكنيشات الليتيوم تريهدراتي | Pt3/mc | [1] | |||
| NaTcO4 | بيرتكنيشات الصوديوم | رباعي الزوايا | a=5.342 c=1.874 | 338.91 | تمتص الماء من الغلاف الجوي | [1] |
| NaTcO4•H2O | بيرتكنيشات الصوديوم مونوهيدراتي | [1] | ||||
| NaTcO4•2H2O | بيرتكنيشات الصوديوم تريهيدراتي | [1] | ||||
| NaTcO4•4H2O | بيرتكنيشات الصوديوم تيترهيدراتي | [1] | ||||
| KTcO4 | بيرتكنيشات البوتاسيوم | رباعي الزوايا | a=5.647 c=12.91 | 411.73 | يستخدم لإعداد المواد المشعة | [1] |
| RbTcO4 | بيرتكنيشات الروبيديوم | رباعي الزوايا | a=5.762 c=13.543 | 449.65 | [1] | |
| CsTcO4 | بيرتكنيشات السيزيوم β | متعامد المحاور أو معين | a=5.737 b=5.92 c=14.341 | 486.38 | [1] | |
| CsTcO4 | بيرتكنيشات السيزيوم α | رباعي الزوايا | a=5.898 c=14.38 | درجة حرارة عالية >470K; درجة حرارة عالية ومضطربة | [1] | |
| TlTcO4 | بيرتكنيشات الثليوم | متعامد المحاور أو معين | [1] | |||
| TlTcO4 | بيرتكنيشات الثليوم | رباعي الزوايا | درجات حرارة عالية | [1] | ||
| NH4TcO4 | بيرتكنيشات الأمونيوم | رباعي الزوايا | يمكن توفير تكنيشيوم في هذا النموذج | [1] | ||
| AgTcO4 | بيرتكنيشات الفضة | رباعي الزوايا | [1] | |||
مراجع
- Weaver, Jamie؛ Soderquist, Chuck Z.؛ Washton, Nancy M.؛ Lipton, Andrew S.؛ Gassman, Paul L.؛ Lukens, Wayne W.؛ Kruger, Albert A.؛ Wall, Nathalie A.؛ McCloy, John S. (21 فبراير 2017)، "Chemical Trends in Solid Alkali Pertechnetates"، Inorganic Chemistry، doi:10.1021/acs.inorgchem.6b02694.
- بوابة طب
- بوابة صيدلة
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.