تعابر كروموسومي
التعابر الكروموسومي أو التعابر هو تبادل للمادة الوراثية بين كروموسومات متماثلة ينتج عنه كروموسومات مؤشبة أثناء التكاثر الجنسي، وهو أحد المراحل النهائية لإعادة التركيب الجيني الذي يظهر في الطور الأول 1 من التثخن في الإنقسام المنصف خلال عملية تسمى الاقتران الصبغي. يبدأ الاقتران الصبغي قبل تشكل مركب المشبكي الخيطي ولا يكتمل حتى اقتراب نهاية الطور الأول 1. يظهر التعابر الكروموسومي حين تنفطر مناطق متماثلة في كروموسومات متماثلة ثم تعاود الارتباط في كروموسوم آخر.
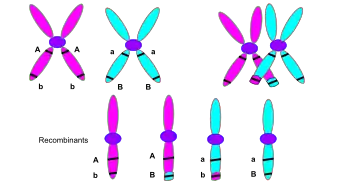
تم وصف التعابر نظريا بواسطة توماس مورغان الذي اعتمد على اكتشاف فرانس ألفونس يانسن الذي وصف الظاهرة سنة 1909 وسماها "chiasmatypie" المصطلح تصالب "Chiasma " مرتبط بالتعابر أو له نفس المعنى، رأى مورغان مباشرة أهمية تفسير يانسن السيتولوجي للتصالب بالنسبة لنتائجه التجريبية حول الوراثة لدى الدروسوفيلا. قواعد التعابر الكروموسومي تم إثباتها أول مرة بواسطة هارييت كريتون وباربرا مكلنتوك سنة 1931. [2]
تواتر التعابر بين منطقتي جينين (واسمات جينية) هي قيمة التعابر. بالنسبة لمجموعة ثابتة من الشروط الجينية والطبيعية، تميل إعادة التركيب الجيني في الكروموسومات أن تكون ثابتة ونفس الأمر صحيح بالنسبة لقيمة التعابر التي تستخدم لإنتاج الخرائط الجينية. [3][4]
المنشأ
توجد نظريتان شائعتان ومتداخلتان تشرحان منشأ التعابر، مأخوذتان من نظريات مختلفة حول منشأ الانقسام المنصف. تعتمد النظرية الأولى على فكرة أن الانقسام المنصف تطور كطريقة لترميم الحمض النووي التالف، وبالتالي فالتعابر هو طريقة جديدة لاستبدال الأجزاء التالفة المحتملة من الحمض النووي. تأتي النظرية الثانية من فكرة أن الانقسام المنصف تطور من التحول البكتيري مع وظيفة مكاثرة التنوع. في عام 1931 اكتشفت باربرا مكلينتوك منشأ الذرة الثلاثية محققةً اكتشافات كبيرة تخص النمط النووي للذرة بما فيها حجم وشكل الكروموسومات. استخدمت مكلينتوك طور الصعود والطور البيني للانقسام الفتيلي لوصف مورفولوجية كروموسومات الذرة، وعرضت فيما بعد أول إظهار خلوي للتعابر في الانقسام المنصف على الإطلاق. من خلال العمل مع الطالبة هارييت كريتون، قدمت مكلينتوك أيضًا مساهمات كبيرة في الفهم البدئي للاعتمادية المتبادلة في الجينات المترابطة.[5][6]
نظرية ترميم الحمض النووي
التعابر وترميم الحمض النووي عمليتان متشابهتان كثيرًا، إذ تستفيدان من العديد من المعقدات البروتينية المتماثلة.[5][7][8] في تقريرها المعنون «أهمية استجابات الجينوم للتحدي» درست مكلينتوك الذرة لتوضح كيف سيغير جينوم الذرة نفسه للتغلب على عقبات بقائه. استخدمت 450 من النباتات ذاتية التلقيح التي تلقت من كل نبات أبوي كروموسومًا بنهاية ممزقة. استخدمت الأنماط المعدلة للتعبير الجيني في أجزاء مختلفة من أوراق نبات الذرة لتظهر أن العناصر القابلة للنقل (العناصر المسيطرة) تختبأ ضمن الجينوم وأن حركتها تتيح لها المجال لتغيير عمل الجينات في مواقع مختلفة. يمكن لهذه العناصر أيضًا إعادة هيكلة الجينوم في أي مكان من عدد قليل من النيوكليوتيدات إلى قطاعات كاملة من الكروموسومات. تضع العناصر المسؤولة عن إعادة التركيب والبدائل أساسًا للنيكليوتيدات على طول تسلسل الحمض النووي. أحد هذه المركبات البروتينية المعينة التي تُحفظ هو راد 51 وهو بروتين مشترك في إعادة التركيب، أظهر أن له دور جوهري في عملية ترميم الحمض النووي وكذلك في التعابر. رُبطت العديد من الجينات الأخرى في ذبابة الفاكهة أيضًا بكلا العمليتين، من خلال إظهار أن الطفرات في هذه المواقع المحددة لا يمكن أن تخضع لعملية ترميم الحمض النووي ولا التعابر. تتضمن هذه الجينات مي 41 ومي 9 وإتش دي إم وإس بّي إن إيه وبي آر سي إيه 2. تدعم هذه المجموعة الضخمة من الجينات نظرية العلاقة التطورية الوثيقة. علاوةً على ذلك، وُجد أن عملية ترميم الحمض النووي والتعابر تفضل مناطق مشابهة على الكروموسومات. وجد في تجربة باستخدام رسم الخرائط التهجينية الشعاعي على الكروموسوم 3 بي في القمح أن التعابر وترميم الحمض النووي يحصلان في نفس المناطق في الدرجة الأولى. علاوةً على ذلك، اعتقد بأن التعابر يحصل كاستجابة لظروف الشدة المؤدية إلى تلف الحمض النووي على الأغلب.[9][10][11]
مراجع
- Griffiths, AJF؛ Gelbart, WM؛ Miller, JH؛ وآخرون (1999)، "Modern Genetic Analysis: Mitotic Crossing-Over"، New York: W. H. Freeman، مؤرشف من الأصل في 16 ديسمبر 2019.
- Creighton H, McClintock B (1931)، "A Correlation of Cytological and Genetical Crossing-Over in Zea Mays"، Proc Natl Acad Sci USA، 17 (8): 492–7، doi:10.1073/pnas.17.8.492، PMC 1076098، PMID 16587654. (Original paper)
- Rieger R. Michaelis A., Green M. M. (1976)، Glossary of genetics and cytogenetics: Classical and molecular، Heidelberg - New York: Springer-Verlag، ISBN 3-540-07668-9.
{{استشهاد بكتاب}}: صيانة CS1: يستخدم وسيط المؤلفون (link) - King R. C., Stransfield W. D. (1998): Dictionary of genetics. Oxford University Press, New York, Oxford, (ردمك 0-19-50944-1-7); (ردمك 0-19-509442-5).
- Harris Bernstein, Carol Bernstein and Richard E. Michod (2011). Meiosis as an Evolutionary Adaptation for DNA Repair. Chapter 19 in DNA Repair. Inna Kruman, editor. InTech Open Publisher. دُوِي:10.5772/25117 http://www.intechopen.com/books/dna-repair/meiosis-as-an-evolutionary-adaptation-for-dna-repair نسخة محفوظة 10 فبراير 2021 على موقع واي باك مشين.
- Bernstein, H؛ Bernstein, C (2010)، "Evolutionary origin of recombination during meiosis"، BioScience، 60 (7): 498–505، doi:10.1525/bio.2010.60.7.5.
- Dangel, NJ؛ Knoll, A؛ Puchta, H (2014)، "MHF1 plays Fanconi anaemia complementation group M protein (FANCM)-dependent and FANCM-independent roles in DNA repair and homologous recombination in plants."، Plant J، 78 (5): 822–33، doi:10.1111/tpj.12507، PMID 24635147.
- Saponaro, M؛ Callahan, D؛ Zheng, X؛ Liberi, G (2010)، "Cdk1 Targets Srs2 to Complete Synthesis-Dependent Strand Annealing and to Promote Recombinational Repair"، PLoS Genet، 6 (2): e1000858، doi:10.1371/journal.pgen.1000858، PMC 2829061، PMID 20195513.
- Kumar, A؛ Bassi, F؛ Paux, E (2012)، "DNA repair and crossing over favor similar chromosome regions as discovered in radiation hybrid of Triticum"، BMC Genomics، 13 (339): 339، doi:10.1186/1471-2164-13-339، PMC 3443642، PMID 22827734.
- Steinboeck, F (2010)، "The relevance of oxidative stress and cytotoxic DNA lesions for spontaneous mutagenesis in non-replicating yeast cells."، Mutat Res، 688 (1–2): 47–52، doi:10.1016/j.mrfmmm.2010.03.006، PMID 20223252.
- Nedelcu, M؛ Marcu, O؛ Michod, RE (2004)، "Sex as a response to oxidative stress: a twofold increase in cellular reactive oxygen species activates sex genes"، Proc. R. Soc. B، 271 (1548): 1591–1596، doi:10.1098/rspb.2004.2747، PMC 1691771، PMID 15306305، مؤرشف من الأصل في 15 ديسمبر 2019، اطلع عليه بتاريخ 10 مارس 2015.
- بوابة علم الأحياء الخلوي والجزيئي