تعديل كريسبر
تقنية كريسبر (من الإنجليزية Clustered Regularly Interspaced Short Palindromic Repeats) هي تقنية في الهندسة الوراثية يمكن من خلالها تعديل جينومات الكائنات الحية. طريقة من طرق تعديل الكائنات الحية وراثيا على أساس نسخة مبسطة من بروتين كريسبر المضاد للفيروسات.
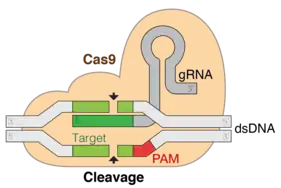
هذه الظاهرة تتمثل في دفاع البكتيريا عن نفسها عندما يغزوها الفيروسات من خلال تكاثرها أي الفيروسات داخل البكتيريا فتقتلها. للبكتيريا نظام طبيعي يفرز إنزيما يسمى كاس 9 تصدره فيقترن بالجزء المعين من الحمض النووي للفيروس (القاتل) ويعيق نسخه وبالتالي يمنع تكاثره داخل البكتيريا وتسلم البكتيريا من الموت المحقق. وقد استخدمت نفس التقنية للبحث عن تسلسلات الحمض النووي المرتبطة بصفات معينة مما يمكن معها إصلاح الجينات المعطلة واستبدالها بجينات سليمة أو معدلة.[1]
وتمتاز تقنية كريسبر بأنها رخيصة التكلفة، وسهلة الاستعمال، وتتيح للعلماء تعديل الجينات من خلال «مقص» جيني يضاهي في عمله برنامجا لمعالجة النصوص، ويمكنه رصد التشوهات الجينية واستبدالها بعناصر أخرى في الحمض النووي.[2]
نبذة تاريخية
طرق أخرى
في بداية العقد الأول من القرن الحادي والعشرين، بدأ الباحثون الألمان في تطوير إنزيمات نوكلياز أصبع الزنك، وهي بروتينات اصطناعية تمكنها نطاقات ربط الدنا (الحمض النووي الريبوزي منقوص الأكسجين) الخاصة بها من إنشاء فواصل مزدوجة السلسلة في نقاط محددة من الدنا. تتمتع إنزيمات نوكلياز أصبع الزنك بدقة أعلى وتتميز بحجمها الصغير مقارنةً بالبروتين المرتبط بكريسبر 9. مع ذلك، ليست شائعة الاستخدام بقدر الطرق المستندة إلى كريسبر. في عام 2010، قدم نوع آخر من النوكلياز الاصطناعي، سمي بنوكلياز المستجيب الشبيه بمنشطات النسخ، طريقة أسهل لخلق فواصل مزدوجة السلسلة في موقع محدد من الدنا. تتطلب الطريقتان السابقتان تصميم وإنشاء بروتين مخصص لكل سلسلة مستهدفة من الدنا، وهي عملية أكثر صعوبة واستهلاكًا للوقت مقارنةً بتصميم حمض نووي ريبوزي موجه. يعتبر تصميم التكرارات العنقودية المتناظرة القصيرة منتظمة التباعد أسهل بكثير، لأن العملية تتطلب تخليق سلسلة قصيرة من الحمض النووي الريبي فقط، وهو إجراء مستخدم مسبقًا على نطاق واسع في العديد من تقنيات البيولوجيا الجزيئية الأخرى (كإنشاء البادئات قليلة النوكليوتيد مثلًا).[3]
لا تكبح بعض الطرق عمل الجين تمامًا كتقنية تدخل الرنا مثلًا. في المقابل، تعمل تقنية كريسبر ونوكلياز أصبع الزنك ونوكلياز المستجيب الشبيه بمنشطات النسخ على تعطيل المورثة بشكل غير عكوس. يمكن لتقنية كريسبر أيضًا استهداف العديد من مواقع الدنا في وقت واحد ببساطة عن طريق إدخال أنواع مختلفة من الرنا الموجه. إضافة لذلك، تعتبر تكاليف استخدام تقنية كريسبر منخفضة نسبيًا.[4][4][5]
اكتشاف التقنية
في عام 2012، نشرت جنيفر داودنا وإيمانويل شاربنتييه اكتشافهما الذي يفيد بإمكانية برمجة تقنية كريسبر- كاس9 باستخدام الرنا لتعديل دنا الجينوم. يصنف هذا الاكتشاف اليوم كأحد أهم الاكتشافات في تاريخ علم الأحياء.[6]
براءات الاختراع والتسويق
اعتبارًا من نوفمبر 2013، امتلكت مختبرات ساجي (جزء من مجموعة هورايزون ديسكفري) حقوقًا حصرية من إحدى الشركات لإنتاج وبيع جرذان معدلة وراثيًا، وحقوقًا غير حصرية لنماذج الفئران والأرانب. بحلول عام 2015، حصلت ثيرمو فيشر العلمية على حقوق فكرية مرخصة من شركة تول جين لتطوير مجموعات كاشف كريسبر.[7]
اعتبارًا من ديسمبر 2014، أصبحت حقوق براءة اختراع كريسبر محل نزاع. أنشئت العديد من الشركات بهدف تطوير أدوية وأدوات بحث مرتبطة بها. مع تكثيف الشركات للتمويل، أثيرت شكوك حول إمكانية تحول تقنية كريسبر بسرعة إلى مصدر للربح. في فبراير 2017، حكم مكتب براءات الاختراع الأمريكي في قضية تداخل براءات الاختراع التي رفعتها جامعة كاليفورنيا فيما يتعلق ببراءات الاختراع المقدمة لمعهد برود، ووجد أن براءات اختراع الأخير مختلفة عن اختراعات جامعة كاليفورنيا، بسبب ادعاءات تزعم تطبيق تقنية كريسبر- كاس9 على الخلايا حقيقية النواة.[8][8]
بعد فترة وجيزة، قدمت جامعة كاليفورنيا استئنافًا لهذا الحكم. حكم مكتب الولايات المتحدة للبراءات والعلامات التجارية في مارس 2022 ضد جامعة كاليفورنيا، مشيرًا إلى تقديم معهد برود ملفه أولًا. أثر القرار على العديد من اتفاقيات الترخيص المقدمة من جامعة كاليفورنيا في بيركلي. صرحت جامعة كاليفورنيا عن نيتها استئناف قرار مكتب الولايات المتحدة الأمريكية.[9]
الأحداث الأخيرة
في مارس 2017، أعلن مكتب براءات الاختراع الأوروبي أنه سيسمح بتعديل جميع أنواع الخلايا لمعهد ماكس بلانك في برلين وجامعة كاليفورنيا وجامعة فيينا، وفي أغسطس 2017، أعلن المكتب أنه ينوي الموافقة على تقنية كريسبر في طلب براءة الاختراع الذي قدمته شركة ميليبور سيغما. ولكن اعتبارًا من أغسطس 2017، أصبح وضع براءات الاختراع في أوروبا معقدًا، فقد تنافست شركتي ميليبور سيغما وتول جين وجامعتي فيلنيوس وهارفارد على ذلك، إضافةً لجامعة كاليفورنيا ومعهد برود.[7]
في يوليو 2018، قضت محكمة العدل الأوروبية بأن تحرير جينات النباتات يجعلها تندرج تحت الأغذية المعدلة وراثيًا، وبالتالي سيشرف الاتحاد الأوروبي على تقنية كريسبر من خلال قوانينه ولوائحه الخاصة بالكائنات المعدلة وراثيًا.
في فبراير 2020، أظهرت تجربة أمريكية سلامة استخدام تقنية كريسبر للتعديل الجيني على ثلاثة مرضى مصابين بالسرطان.
في أكتوبر 2020، حصلت الباحثتان إيمانويل شاربنتييه وجنيفر داودنا على جائزة نوبل في الكيمياء لعملهما في هذا المجال. وبذلك، سجلهما التاريخ كأول امرأتين تتقاسمان هذه الجائزة بدون مساهم ذكر.
في يونيو 2021، انتهت أول تجربة سريرية صغيرة لتعديل الجينات بتقنية كريسبر عبر الوريد لدى البشر، وقدمت نتائج واعدة.
في سبتمبر 2021، طرح أول طعام معدل بتقنية كريسبر للبيع العام في اليابان، فقد عدلت الطماطم وراثيًا لتحوي خمسة أضعاف الكمية الطبيعية من حمض الغاما-أمينوبيوتيريك. طبقت تقنية كريسبر لأول مرة على الطماطم في عام 2014. [10]
في ديسمبر 2021، أعلنت اليابان عن سماحها ببيع أولى الحيوانات البحرية/ المأكولات البحرية المعدلة وراثيًا باستخدام تقنية كريسبر وثاني نوع من الأطعمة المعدلة باستخدام هذه الطريقة. أجري التعديل على سمكتين، عدلت الأولى لتنمو إلى ضعف الحجم الطبيعي بسبب خلل هرمون اللبتين الذي يتحكم في الشهية، بينما عدلت الأخرى لتنمو إلى نحو 1.2 من متوسط الحجم الطبيعي مع تناولها نفس الكمية من الطعام، وذلك بسبب تعطيل الميوستاتين الذي يثبط نمو العضلات.
وجدت دراسة أجريت عام 2022 أن معرفة المزيد عن طماطم كريسبر يحمل تأثير قوي على تفضيلات المشاركين. أظهرت دراسة أجريت في ألمانيا ثبات رأي نحو نصف المشاركين البالغ عددهم 32 فيما يتعلق بالطماطم المعدلة، ومعظم هؤلاء الثابتين كانوا من العلماء. في المقابل، أبدى بقية المشاركين استعدادًا متزايدًا لشراء الطماطم المعدلة بتقنية كريسبر، ومعظم هؤلاء كانوا غير علماء.[11]
الحواجز السياسة أمام الهندسة الوراثية
تختلف لوائح السياسة الخاصة بتقنية كريسبر- كاس9 حول العالم. في فبراير 2016، حصل العلماء البريطانيون على إذن من المنظمين لتعديل الأجنة البشرية وراثيًا باستخدام تقنية كريسبر- كاس9 والتقنيات الشبيهة الأخرى. ومع ذلك، منع الباحثون من زرع الأجنة، وأجبروا على إتلافها بعد سبعة أيام.[12]
تملك الولايات المتحدة هيئة تنظيمية دقيقة متعددة الدوائر لتقييم الأطعمة والمحاصيل الجديدة المعدلة وراثيًا. على سبيل المثال، يمنح قانون الحماية من المخاطر الزراعية لعام 2000 وزارة الزراعة الأمريكية سلطة الإشراف على الآفات النباتية أو الأعشاب الضارة واكتشافها ومكافحتها والقضاء عليها وقمعها والوقاية منها أو تأخير انتشارها لحماية زراعة البلاد وبيئتها واقتصادها. يغطي القانون أي كائن حي معدل وراثيًا يستخدم جينوم آفة نباتية محددة مسبقًا أو أي نبات لم يصنف مسبقًا. في عام 2015، نجح ينونغ يانغ في إلغاء تنشيط 16 جين محدد في جينوم الفطر الأبيض ليمنعه من التلون بالبني. لم يضف أي نوع من أنواع الدنا الأجنبية (المعدلة وراثيًا) إلى النبات، ولهذا لا يخضع الفطر لقوانين وزارة الزراعة الأمريكية بموجب القسم 340.2. كان فطر يانغ الأبيض أول كائن حي معدل وراثيًا باستخدام تقنية كريسبر- كاس9 يتجاوز اللوائح الأمريكية.[13]
في عام 2016، نظمت وزارة الزراعة الأمريكية لجنة للنظر في السياسة التنظيمية المستقبلية لتقنيات التعديل الوراثي القادمة. بمساعدة الأكاديميات الوطنية الأمريكية للعلوم والهندسة والطب، اجتمعت مجموعات المصالح الخاصة في 15 أبريل للتفكير في التطورات المحتملة في الهندسة الوراثية خلال السنوات الخمس المقبلة واللوائح الجديدة التي قد تكون مطلوبة نتيجةً لذلك. في عام 2017، اقترحت إدارة الغذاء والدواء قاعدة تصنف تعديلات الهندسة الوراثية على الحيوانات على أنها أدوية حيوانية. وبناءً على ذلك، فرضت على بيعها قواعد تنظيمية صارمة، وحاولت تقليل استغلالها من الأفراد والشركات الصغيرة بهدف الربح.
في الصين، تتناقض الظروف الاجتماعية بشدة مع تلك الموجودة في الغرب، تحمل الأمراض الوراثية وصمة عار شديدة. لهذا السبب، يواجه استخدام هذه التقنية عدد أقل من الحواجز السياسية.
المراجع
- "You are being redirected..."، www.al-madina.com، مؤرشف من الأصل في 30 أبريل 2019، اطلع عليه بتاريخ 30 أبريل 2019.
- "تقنية "كريسبر" للتعديل الجيني"، www.aljazeera.net، مؤرشف من الأصل في 10 أكتوبر 2018، اطلع عليه بتاريخ 30 أبريل 2019.
- "CRISPR and Other Genome Editing Tools Boost Medical Research and Gene Therapy's Reach"، إم آي تي تكنولوجي ريفيو، 11 فبراير 2014، مؤرشف من الأصل في 12 يناير 2016، اطلع عليه بتاريخ 13 أبريل 2014.
- "Applications of CRISPR technologies in research and beyond"، Nature Biotechnology، 34 (9): 933–941، سبتمبر 2016، doi:10.1038/nbt.3659، PMID 27606440، S2CID 21543486.
- "Therapeutic genome editing: prospects and challenges"، Nature Medicine، 21 (2): 121–31، فبراير 2015، doi:10.1038/nm.3793، PMC 4492683، PMID 25654603.
- "Jennifer Doudna, a Pioneer Who Helped Simplify Genome Editing"، نيويورك تايمز، 11 مايو 2015، مؤرشف من الأصل في 8 أبريل 2022، اطلع عليه بتاريخ 8 أكتوبر 2020.
- Shaffer, Catherine (14 مارس 2022)، "Broad defeats Berkeley CRISPR patent"، Nature Biotechnology (باللغة الإنجليزية)، 40 (4): 445، doi:10.1038/d41587-022-00004-2، PMID 35288688، S2CID 247453528، مؤرشف من الأصل في 17 مايو 2022.
- "Broad Wins CRISPR Patent Interference Case"، The Scientist Magazine، 15 فبراير 2017، مؤرشف من الأصل في 11 نوفمبر 2020.
- "UC Berkeley loses CRISPR patent case"، ذا فيرج، 1 مارس 2022، مؤرشف من الأصل في 30 أبريل 2022، اطلع عليه بتاريخ 6 مارس 2022.
- "CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis"، The New England Journal of Medicine، 385 (6): 493–502، أغسطس 2021، doi:10.1056/NEJMoa2107454، PMID 34215024، S2CID 235722446.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - "Neurotransmitters as food supplements: the effects of GABA on brain and behavior"، Frontiers in Psychology، 6: 1520، 06 أكتوبر 2015، doi:10.3389/fpsyg.2015.01520، PMC 4594160، PMID 26500584.
- "A quick guide to CRISPR sgRNA design tools"، GM Crops & Food، 6 (4): 266–76، 2015، doi:10.1080/21645698.2015.1137690، PMC 5033207، PMID 26745836.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - Discovering Genes Responsible for Kidney Diseases (Ph.D.)، University of Toronto، 2013، مؤرشف من الأصل في 4 أغسطس 2021، اطلع عليه بتاريخ 26 ديسمبر 2016.
- بوابة تقانة
- بوابة تقانة حيوية
- بوابة علم الأحياء