لقاح الدنا
لقاح الحمض النووي الريبوزي منقوص الأكسجين ويشار إليه اختصارًا لقاح الدنا؛ هو تقنية تستخدم لحماية الكائن الحي من الأمراض عن طريق حقنه بحمض نووي (دنا) مُهَنْدَس وراثيّا لإنتاج استجابة مناعيّة. ما تزال لقاحات الحمض النووي في طور التجريب وقد تم تطبيقها على عدد من نماذج لأمراض فيروسية وبكتيرية وطفيلية ونماذج مختلفة من الورم. للقاح الحمض النووي عدد من الفوائد التي تفوق التلقيح التقليدي والتي تشمل القدرة على إنتاج مدى أوسع من أنواع الاستجابة المناعية.
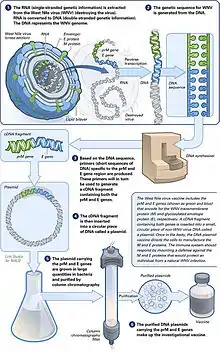
تعتبر اللقاحات واحدة من أعظم إنجازات الطب الحديث؛ حيث ساهمت اللقاحات في الأمم الصّناعيّة في الحد من حالات الجدري التي تحدث طبيعيا وقضت تقريبا على حالات شلل الأطفال، بينما تمت السيطرة بشكل جيد على أمراض أخرى مثل التيفوس وفيروس الروتا والتهاب الكبد(أ) و (ب).[1] تغطي اللقاحات التقليدية على أي حال عددا صغيرا من الأمراض وتتسبب العدوى التي لا تتوفر لقاحات فعالة لمعالجتها بقتل ملايين البشر كل عام وتعد أمراض الإيدز والتهاب الكبد الفيروسي(ج) والملاريا أمثلة شائعة على هذه الأمراض بشكل خاص.
تعتبر لقاحات الجيل الأول لقاحات متعضيّة، وهي إما لقاحات معطلة أو نماذج تم قتلها (مقتولة).[2] اللقاحات الحية والضعيفة مثل لقاحات الجدري وشلل الأطفال بمقدورها إنتاج استجابة للخلايا التائيّة القاتلة (TC أو CTL) واستجابات الخلايا التائية المساعدة (TH) ومناعة الجسم المضاد. غير أن هناك خطرا بسيطا يتمثّل بأن النماذج المضعّفة من مسببات المرض يمكن لها أن تعود لتكوّن شكلا خطرا وتكون قادرة على أن تسبب المرض للأشخاص الذي يعانون من نقص المناعة (كالمصابين بالإيدز). لا تشكّل اللقاحات التي تم قتلها ذات الخطورة، فلا يمكنها أن تنتج استجابات مخصوصة للخلايا التائية القاتلة، ويمكن أن لا تفيد إطلاقا في علاج بعض الأمراض.[2] تم تطوير ما يسمّى بلقاحات الجيل الثاني بهدف تقليل هذه المخاطر. لقاحات الوحيدات هذه تتألّف من مستضدات بروتين معرّفة (مثل الكزاز أو توكسيد الدفتيريا) أو مكوّنات البروتين المطعمة (مثل مضادات الالتهاب الكبدي (ب) السّطحيّة). تعتبر هذه أيضا قادرة على إنتاج خلايا TH واستجابات الأجسام المضادة ولكن ليس استجابات الخلايا التائيّة القاتلة.
تعتبر لقاحات الحمض النووي من لقاحات الجيل الثالث، وتتكون من قطع صغيرة ودائرية من الحمض النووي البكتيري (وتدعى بالبلازميد) والتي تمت هندستها وراثيا لتنتج بروتينا أو اثنين (مستضدات) من مسببات المرض. يحقن لقاح الحمض النووي في خلايا الجسم، بحيث «تقرأ» «الآلية الداخلية» للخلايا المضيفة الحمض النووي وتحوله إلى بروتينات لمسببات المرض. يتم تنبيه جهاز المناعة بحيث يطلق مجموعة من الاستجابات المناعية وذلك عندما يتم تمييز هذه البروتينات كأجسام غريبة عند معالجتها بواسطة الخلايا المضيفة وعرضها على سطحها.[1][2] طورت لقاحات الحمض النووي من تجارب «فاشلة» للعلاج الجيني وأول برهان على استجابة مناعية يسببها البلازميد كانت عندما تم تلقيح فئران ببلازميد يمثّل هرمون النمو البشري منزوع الأجسام المضادة بدلا من تغيير النمو.[3]
الاستخدام الحالي
حتى الآن، أثارت بضع محاولات تجريبية استجابة قوية بما يكفي للحماية ضد الأمراض، وبينما لا يزال عدم جدوى التقنية -وهو شيء محير- غير مثبت بشكل قاطع في التجارب على الإنسان. غير أنه في يونيو 2006 أعلنت نتائج إيجابية للقاح الحمض النووي الخاص بإنفلونزا الطيور[4] كما وتم التصديق على لقاح دنا بيطري لحماية الخيول من فيروس غرب النيل.[5][6] في أغسطس عام 2007، أفيد بنجاح الدراسة الأولية لتلقيح الدنا ضد مرض التصلب المتعدد.[7]
منافع ومضار لقاحات الحمض النووي
| منافع | مضار |
|---|---|
|
|
نواقل البلازميد المستخدمة في التطعيم
تصميم الناقل
تنتخب لقاحات الحمض النووي أفضل استجابة مناعية عند استخدام نواقل تعبير نشطة للغاية وهي بلازميدات تتكون عادة من محفز فيروسي قوي يقود عمليات نسخ وترجمة الجين (أو الدنا المتمم) ذي العلاقة في الكائنات الحية.[9] ربما يتم أحيانا دمج الإنترون (أ) لتحسين ثبات الرنا الرسول (بالإنجليزية: mRNA) وبالتالي زيادة تقديم البروتين.[10]
يمكن للبلازميدات أن تحتوي أيضا على إشارة إنهاء متعددة الأدننة/نسخيّة قوية مثل هرمون النمو البقري أو سلاسل بيتا جلوبولين الأرنبية متعددة الأدننة.[1][2][11] تبنى نواقل متعدد السيترونات أحيانا لتقدّم أكثر من مستمنع أو لتعرض مستمنعا وبروتينا مناعيا محفزا.[12]
لأن البلازميد يعتبر «وسيلة النقل» التي يتم تقديم المستمنع من خلالها، يعتبر تحسين تصميم النواقل للحصول على أقصى تقديم بروتيني أمرا ضروريا.[12] يعتبر تحسين استخدام الكودون (أو الرّامز) لأحماض الرنا الرسولة المسببة للمرض في الخلايا حقيقة النواة أحد طرق تحسين التعبير البروتيني. غالبا ما تمتلك مسببات الأمراض محتويات AT أكثر من الأنواع التي تم تمنيعها، ولذا فإن تعديل التسلسل الجيني للمستمنع ليؤثر على الكودونات التي تستخدم بشكل أكثر شيوعا في الأنواع المستهدفة قد يحسّن من تعبيرها.[13]
أمر آخر يجب أخذه في الاعتبار هو اختيار المحفّز، تم استخدام المحفّز الخاص بالفيروس القردي 40 (بالإنجليزية: SV40) حتى أثبتت الدراسات أن المحفّز الخاص بفيروس روس ساركوما (بالإنجليزية:RSV) يحوي معدلات تقديم أعلى.أمكن مؤخرا زيادة معدلات التقديم عن طريق استخدام المحفّز المبكّر الفوريّ للفيروس المضخم للخلايا (بالإنجليزية: CMV). تضمين فيروس قرد ميسون – فايزر (بالإنجليزية: MPV-CTE)مع/بدون تسريع قد زاد من غطاء التعبير الجيني. زيادة على ذلك فإن تركيب CTE المسرَّع كان أكثر قدرة على توليد المناعة من فيروس قرد ميسون – فايزر بمفرده.[14] ضُمّنَت تعديلات إضافية لتحسين معدلات التعبير مثل إدخال سلاسل المعزّز، سلاسل تصنيع الإنترونات وقائد ثلاثي الفيروس الغدي (بالإنجليزية:TPL) والتعديلات على سلاسل الإنهاء متعددة الأدننة والنسخية.[2] مثال على بلازميد تلقيح الدنا هو مركب بولي فينيل أسيتات (بالإنجليزية:pVAC) الذي يستخدم المحفّز SV40.
تصميم إدخال اللقاح
يمكن أن توجّه المُستمنعات لتستهدف مقصورات خلوية مختلفة بهدف تحسين استجابات الجسم المضاد أو الخلايا التائيّة السامة. إن المستضدات المفرزة والمستضدات المحاطة بغشاء بلازمي هي أكثر فعالية في حث استجابات الأجسام المضادة من مستضدات العصارات الخليوية بينما يمكن تحسين استجابات الخلايا التائيّة السامة عن طريق استهداف المستضدات بغرض انحلال السيتوبلازم والدخول المتتابع إلى مسار معقدات التوافق النسيجي الكبير (بالإنجليزية: MHC) من الصنف الأول.[1] عادة ما يتحقق هذا عن طريق إضافة إشارات شظايا النيتروجين الطرفي لبروتين اليوبيكيتين (بالإنجليزية:ubiquitin).[15][16]
يمكن أن يؤثر تشكيل البروتين أيضا على استجابة الجسم المضاد، حيث يكون للتركيب «المنظَّم» (مثل الحبيبات القيروسيّة) فعاليّة تفوق تلك غير المنظَّمَة.[17] تمتلك سلاسل الجينات المصغرة (أو إبتوبات MHC من الصنف الأول) من مسببات أمراض مختلفة القدرة على إحداث استجابات الخلايا التائية السامة لعدد من مسببات الأمراض خصوصا إذا ما تم تضمين إبتوب (بالإنجليزية:epitope) الخلايا التائيّة المساعدة (بالإنجليزية:TH).[1]
طرق الإيصال

تم إدخال لقاحات الدنا في أنسجة الحيوان بعدد مختلف من الطرق. يستعرض الجدول رقم 2 طرق الإيصال هذه باختصار مع ذكر فوائد ومضار معظم الطرق المستخدمة بإيجاز في الجدول رقم 3. الطريقتان الأكثر شهرة هما حقن الدنـا في محلول ملحي باستخدام إبرة تحت جلدية والأخرى هي المدفع الجيني. يمكن تصفح موقع الأمريكي العلمي للاطلاع على مخطط لبناء لقاح بلازميد الدنا وتسليمه فيما بعد عبر هاتين الطريقتين في جسم المستضيف.[18] غالبا ما تعطى حقنة المحلول الملحي عن طريق حقنها في العضل (بالإنجليزية: IM) في العضلات الهيكيلية أو الحقن في الجلد (بالإنجليزية: ID) بحيث يتم إيصال الدنـا للأجواء الخارج الخلوية. بمساعدة التثقيب الكهربائي،[19] يمكن عطب ألياف العضلات مؤقتا بواسطة السموم الفطرية مثل البيوبيفاكين (بالإنجليزية: bupivacaine) أو باستخدام محاليل ملحية مفرطة التوتر أو السكروز.[2] يمكن أن تتأثر الاستجابات المناعية لطريقة الإيصال هذه بعدة عوامل تشمل نوع الإبرة[8] ومحاذاتها وسرعة الحقن وحجم الحقن ونوع العضل والعمر والجنس والحالة الفسيولوجية للحيوان الذي يتم حقنه.[2] الإيصال باستخدام مدفع الجينات وهي الطريقة الأخرى المستخدمة في الإيصال غالبا، تسرّع المقذوفات الدنا البلازميدي (pDNA) الذي يكثَّف في حويصلات الذهب أو التنغستن في الخلايا الهدف باستخدام الهيليوم المضغوط كمسرّع.[2][12]
تضمنت طرق إيصال بديلة تقطير الهباء الجوي للدنا المجرّد على الأسطح المخاطيّة مثل غشاء الأنف والرئة[12] وتضمنت أيضا الإدارة الموضعية للدنا البلازميدي للغشاء المخاطي في العين[20] والمهبل. الإيصال الخاص بالأسطح المخاطية يمكن تحقيقه عن طريق تحضيرات الحويصلات الكاثودية (الموجبة) في الدنا[1] والكرات الميكروية المتحلّلة حيّويا[21][12] ونواقل عصية الدوسنطاريا(بالإنجليزية: Shigella) والليستريا(بالإنجليزية:Listeria) المضعّفة لإعطاء الدواء عن طريق الفم للغشاء المخاطي المعوي[22] ونواقل فيروس شلل الأطفال المطعمّة.[12]
تحدد طريقة الإيصال جرعة الدنـا اللازمة لتحقيق استجابة مناعية فعالة. تتطلب حُقَنُ المحاليل الملحية مقادير مختلفة من الدنا تتراوح بين 10 مايكرو جرام إلى 1 ميللي جرام في حين يتطلب الإيصال بواسطة المدفع الجيني ما مقداره 100 إلى 1000 مرة أقل من الدنـا من حقن المحلول الملحي في العضل لإثارة استجابة مناعية فاعلة.[23] ويلزم بشكل عام ما بين 2.0 مايكرو جرام إلى 20 مايكرو جرام، مع أنه تمت تسجيل كميات أصغر بحجم 16 نانوجرام.[2] تختلف هذه الكميات من جنس لآخر، حيث يلزم للفئران مثلا دنا أقل بـ 10 مرات من الثدييات.[1] تتطلب حقن المحاليل الملحية دنا أكثر بسبب الحاجة إلى توصيل الدنا إلى الأجواء الخارج الخلوية للنسيج الهدف (وعادة ما تكون العضلات) بحيث يتجاوز العوائق الفيزيائية (مثل الغلالة القاعدية وكميات كبيرة من النسيج الضام على سبيل المثال) قبل أن تتناولها الخلايا بينما يقذف المدفع الجيني بالدنا مباشرة داخل الخلايا مما يتسبب 'بفقدان' أقل.[1][2]
طريقة أخرى لتلقيح الدنا هي مكتبة التعبير المناعية (بالإنجليزية: ELI). باستخدام هذه التقنية يحتمل أن يتم توصيل كل الجينات من مسببات الأمراض مرة واحدة الأمر الذي قد يكون نافعا لمسببات الأمراض التي يصعب تهذيبها أو تخفيفها.[2] يمكن استخدام ELI لتحديد جينات مسببات الأمراض التي تُحْدِث استجابة وقائية. تم اختبار التقنية على المفطورة الرئوية ومسبب التيفوس الفأري مع جينوم صغير نسبيا ووجد أنه يمكن حتى لمكتبات التعبير الجزئية أن تحدث حماية من الاختبار التالي.[24]
| طريقة الإيصال | تركيب الدنا | النسيج المستهدف | كمية الدنا | |
|---|---|---|---|---|
| الطريق الخلالي أو الزرقي | الحقن (إبرة تحت جلدية) | محلول مائي في محلول ملحي | الإبر العضلية (هيكلية)؛ الإبر داخل الجلد؛ (الإبر الوريدية، الإبر تحت الجلد والحقن داخل الصِّفاق بنجاح متفاوت) | كميّات كبيرة (100-200 مايكرو جرام تقريبا) |
| مدفع الجينات | خرزات الذهب المغلفة بالدنا | ED (جلد البطن)؛ الغشاء المخاطي المهبلي؛ العضلات التي يمكن إجراء الجراحة عليها وباقي الأعضاء | كميّات صغيرة (أقل مقدار 16 نانو جرام) | |
| حقن هوائي (نفّاث) | محلول مائي | ED | عالية جدا (بقدر 300 مايكرو جرام) | |
| التطبيق الموضعي | محلول مائي | بصرية؛ داخل المهبل | كميات صغيرة (تصل حتى 100 مايكرو جرام) | |
| عن طريق السايتوفيكتين | الليبوزومات (كاثودية)؛ كرات ميكروية؛ نواقل الفيروس الغدّي المطعّمة؛ ناقل الشيغيللا المضعفة؛ صيغ دهنيات الهباء الجوي الكاثودية | IM؛ IV (ليعدي الأنسجة بشكل منظّم)؛ الحقن داخل الصِّفاق؛ أغشية الأنف والرئة المخاطيّة؛ التحصين الفموي بواسطة الغشاء المخاطي المعوي | متنوّع | |
| طرق الإيصال | الفائدة | الضرر |
|---|---|---|
| الحقن في العضل أو داخل الجلد |
|
|
| المدفع الجيني |
|
|
| الحقن النفّاث |
|
|
| الإيصال عن طريق الليبوزومات |
|
|
الاستجابة المناعية التي أثارتها لقاحات الحمض النووي
استجابات الخلايا التائيّة المساعدة
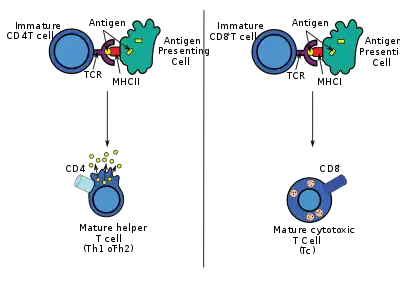
يستطيع تحصين الدنـا إثارة مجموعة من استجابات الخلايا التائيّة المساعدة تشمل توالد الليمف وتوليد تشكيلة من سجل (بالإنجليزية: profile) السايتويكنات. هناك فائدة عظمى للقاحات الدنا ألا وهي سهولة التلاعب بها لتوجيه نوع الخلايا التائية المساعدة نحو استجابة من النوع TH1 أو TH2.[25] لكل نوع من هذه الاستجابة أنماط مميزة من تعبير اللمفوكينات والعقديات والتعبير الخاص بأنواع محددة من الجلوبيولين المناعي وأنماط من تهريب الليمفوكينات وأنواع الاستجابات المناعية الفطريّة المولّدة.
إثارة أنماط مختلفة من الخلايا التائيّة المساعدة
يتأثر نوع الخلايا التائيّة المساعدة التي تتم إثارتها بطريقة الإيصال ونوع المستمنع الذي يتم التعبير عنه، كما يتأثر أيضا باستهداف المقصورات الليمفاوية المختلفة.[2][26] عادة ما تميل إبرة حقن المحلول الملحي (سواء أكانت IM أو ID) لإنتاج استجابات من النوع TH1 بينما يثير الإيصال باستخدام المدفع الجيني استجابات من النوع TH2.[25][26] ويكون هذا صحيحا في حالة الخلايا والمستضدات البلازمية المرتبطة بالغشاء، ولكن ليس في حالة المستضدات المُفْرِزَة والتي يبدو أنها تنتج استجابات TH2 بغض النظر عن طريقة الإيصال.[27]
يكون نوع الخلايا التائية المساعدة التي يتم إثارتها ثابتا عبر الزمن عموما، ولايتغير هذا النوع عند الاختبار أو بعد التحصينات اللاحقة والتي قد تثير عادة النوع المضاد من الاستجابة في الحيوان البدائي.[25][26] برغم ذلك قام مور (1995)[9] بتحصين وتعزيز الفئران ب (دنـا بلازميدي) يشفّر بروتينات غلاف الحيوان البوغي لمُتَصَوِّرة يولي (بالإنجليزية:Plasmodium yoelii) لملاريا الفأر (بالإنجليزية: PyCSP) ووجد بأن الاستجابة الأولية من النوع TH2 قد تغيرت بعد الحقن لتصبح استجابة من النوع TH1.
الآليّة الأساس لإثارة أنماط مختلفة من الخلايا التائيّة المساعدة
من غير المفهوم بعد كيف يمكن لهذه الأنواع المختلفة من تحصين الدنا أو أنواع المستضدات التي يعبَّر عنها أن تثير سجلات مختلفة للخلايا التائية المساعدة. كان الاعتقاد بأن الكميات الكبيرة نسبيا من الدنا التي تستخدم في حقن IM كانت هي المسؤولة عن حث استجابات TH1. ولكن على أية حال، أثبتت التجارب أن الجرعة لا تحدث اختلافا في نوع TH.[25] لقد تبيّن أن نوع الخلايا التائيّة المساعدة التي يتم إثارتها يتم تحديدها بواسطة حالات متباينة من الخلايا المقدمة (العارضة) للمستضد. يمكن للخلايا التغصنيّة أن تتباين لتكوّن إنترلوكن-12 مفرزا (والذي يدعم تطور خلية TH1) أو إنترلوكن-4 (والذي يدعم استجابات TH2).[28] الدنا البلازميدي الذي يتم حقنه عن طريق الإبرة يلقّم خلويّا في داخل الخلية التغصنيّة التي يتم حفزها بعد ذلك لتتمايز لإنتاج سايتوكين خلايا TH1،[29] بينما يقذف المدفع الجيني الدنا مباشرة داخل الخليّة متجاوزا بذلك تحفيز خلايا TH1.
الاستخدامات العملية للخلايا التائيّة المساعدة المستقطبَة
إن الاستقطاب في الخلايا التائيّة المساعدة مفيد في التأثير على استجابات الحساسية وأمراض المناعة الذاتية. يكون الهدف في أمراض المناعة الذاتية هو تحويل استجابة خلايا TH1 التي تدمر نفسها ذاتيا (مع نشاطها المرتبط بالخلية اللمفاوية التائية السامة للخلايا) إلى استجابة خلايا TH2 غير مدمّرة. تم تطبيق هذه الطريقة بنجاح في تجهيز مرحلة ما قبل المرض الخاصة بنوع مرغوب من الاستجابة في النموذج ما قبل السريري[1] وثبت نجاحه إلى حد ما في تحويل الاستجابة إلى مرض تم إنشاؤه بالفعل.[30]
استجابات الخلية اللمفاوية التائية السامة للخلايا
إحدى فوائد تلقيح الدنا العظمى هي قدرتها على حث الخلايا الليمفاوية التائية السُمّية (CTL) بدون الخطرالمتأصل المرتبط باللقاحات الحيّة. يمكن زيادة استجابات الخلايا الليمفاوية التائية السُمّية ضد إبتوبات (المواقع المستضدية) الخلايا الليمفاوية التائية السُمّية (CTL) السائدة والمتنحيّة مناعيا[21][31] وكذلك إبتوبات CTL شبه المهيمنة [21] بطريقة تبدو مقلّدة للعدوى الطبيعية. قد تكون هذه وسيلة ناجعة في تقييم ابتوبات الخلايا الليمفاوية التائية السُمّية (CTL) لمستضد ودورها في توفير المناعة.
تميّز الخلايا الليمفاوية التائية السُمّية الببتيدات الصغيرة (8-10 أحماض أمينيّه) المعقدة لـجزيئات معقدات التوافق النسيجي الكبير من الصنف الأول (ريستيفو-1995). تشتق هذه الببتيدات من بروتينات العصارات الخلوية التي يتم تكسيرها وإيصالها إلى جزيئات MHC من الفئة 1 داخل الشبكة الإندوبلازمية (أو ما يعرف بـ ER).[32] استهداف منتجات الجين مباشرة داخل الشبكة الإندوبلازمية (عن طريق إضافة سلسلة الإدخال الأمينيّة الطرفيّة) يجب أن يحسّن من استجابات CTL. تم إثبات ذلك بنجاح بواسطة اللقاحات الفيروسية المطعمة التي تقدّم بروتينات الإنفلونزا[32] ولكن لا بد من أن ينطبق المبدأ ذاته على لقاحات الدنا أيضا. أظهر استهداف المستضدات بسبب الانحلال الخلوي (وبالتالي الدخول إلى مسار MHC من الفئة الأولى) عن طريق إضافة سلاسل إشارة اليوبيكيتين أو تغيير سلاسل الإشارات الأخرى فعاليته في زيادة استجابات CTL.[16]
يمكن زيادة استجابات CTL عن طريق مشاركة التلقيح مع الجزيئات المساعدة للتنبيه مثل B7-1 أو B7-2 للقاحات الدنا ضد البروتين النووي الخاص بالإنفلونزا[31][33] أو محفزات إعمار الخلايا المحببة والملتهمة (بالإنجليزية: GM-CSF) للقاحات الدنا ضد نموذج ملاريا الفئران (P. yoelii).[34] تم إثبات مساهمة مشاركة التلقيح مع البلازميدات التي تشفّر الجزيئات المساعدة للتنبيه IL-12 و TCA3 في زيادة نشاط CTL ضد مستضدات البروتين النووي الخاص بفيروس HIV-1والإنفلونزا.[33][35]
استجابة (الجسم المضاد) الخلطية

استجابات الجسم المضاد التي تستخلصها عمليات تلقيح الدنـا تتأثر بعدد من المتغيرات نذكر بعضها والتي تشمل نوع المستضد الذي تم ترميزه وموقع المستضد المعبَّر عنه (مثال: الخلوية مقابل المفرزة) والعدد وكمية وتكرار عملية التحصين، نوع وطريقة إيصال المستضد على سبيل المثال لا الحصر.
حركيّة استجابة الجسم المضاد
يمكن للاستجابة الخلطية بعد حقنة دنا واحدة أن تكون أطول عمرا بكثير من بعد حقنة واحدة ببروتين مطعم. استجابة الجسم المضاد ضد فيروس التهاب الكبد ب (بالإنجليزية: HBV) مغلف البروتين (بالإنجليزية:HBsAg) تم تعزيزها لمدة تصل لحد 74 أسبوعا بدون مساعدة بينما تم إثبات الحفاظ لمدة أطول على الاستجابة الوقائية لهيماغلوتينين الإنفلونزا في الفئران بعد الإيصال باستخدام مدفع الجينات.[36] تهاجر الخلايا المفرزة للجسم المضاد إلى نخاع العظم والطحال لإنتاج الجسم المضاد على المدى البعيد وعادة ما تتموضع هناك بعد عام واحد.[36]
يمكن تلخيص المقارنات بين الاستجابة المناعية للأجسام المضادة التي تنتجها العدوى الطبيعية (الفيروسية) والتحصين بالبروتين المطعم ووبين التحصين باستخدام الدنا البلازميدي في الجدول رقم 4. تتزايد استجابة الجسم المضاد بواسطة الدنا أبطأ بكثير جدا من حدوث العدوى الطبيعية أو تحصين البروتين المطعّم. يستغرق هذا ما يقارب 12 أسبوعا لوصول ذروة كمية الأجسام المضادة لكل عينة في الفئران برغم أن الحقن يمكن أن يزيد من معدل إنتاج الجسم المضاد. يمكن تفسير هذه الاستجابة البطيئة تبعا لمستويات التعبير المنخفضة للمستضدات التي يتم التعبير عنها خلال أسابيع عديدة مما يعزز المراحل الابتدائية والثانوية من استجابة الجسم المضاد.
| طريقة التحصين | |||
|---|---|---|---|
| لقاح الدنا | البروتين المطعم | العدوى الطبيعية | |
| كمية الدنا المنتِج | نانو جرام | مايكرو جرام | ? (نانو جرام- مايكرو جرام) |
| مدة تقديم الـ Ag | عدة أسابيع | <أسبوع | عدة أسابيع |
| حركية استجابة Ab | ارتفاع بطيء | ارتفاع سريع | ارتفاع سريع |
| عدد التطعيمات للحصول على IgG شره وهجرة خلايا ASC إلى نخاع العظم | واحد | اثنان | واحد |
| أبدال Ab (نماذج الفئران) | معتمدة على C’ أو مستقلة عن C’ | معتمدة على C’ | مستقلة عن C’ |
إضافة إلى ذلك فإن كمية الأجسام المضادة لكل عينة لأجسام مضادة محددة والتي يثيرها تلقيح الدنا هي أقل من تلك التي يتم الحصول عليها بعد التلقيح بواسطة بروتين مطعم. على أي حال فالأجسام التي ينتجها التحصين تظهر انجذابا كبيرا تجاه الببتيدات الأصلية أكثر من الأجسام المضادة التي تنتج من البروتين المطعّم. بمعنى آخر، فإن تلقيح الدنا ينتج استجابة متفوقة نوعيا. يمكن إنتاج الجسم المضاد بعد تلقيح دنا واحد فقط بينما عادة ما تحتاج تلقيحات البروتين المطعم إلى حقن. كما ذكر سابقا، فإن تحصين الدنا يمكن أن يستخدم لتحييز سجل خلايا TH للاستجابة المناعية وأبدال الجسم المضاد والتي لا يحتمل حدوثها سواء مع العدوى الطبيعية أو تحصين البروتين المطعم. استجابات الجسم المضاد التي يحدثها الدنا مفيدة ليس فقط في التحصين ولكن كوسيلة إعداد أيضا. يمكن إنتاج الأجسام المضادة وحيدة ومتعددة النسيلة لاستخدامها ككواشف على سبيل المثال.
الأساس الميكانيكي لإثارة استجابة الدنـا المناعية
آلية امتصاص الدنـا
عندما تم وصف امتصاص وتعبير الدنا المتتابع لأول مرة في الكائنات الحية في خلايا العضلات؛[37] كان الاعتقاد بأن هذه الخلايا كانت فريدة في هذه القدرة وذلك بسبب شبكتها المكثفة من أنابيب T. باستخدام المجهر الالكتروني، تم إثبات أن أن امتصاص الدنا يتم تسهيله بواسطة كهيفات (أو ما يسمى بحفر الكلاذرين غير المغلفة).[38] كشفت الأبحاث المتتابعة أن الخلايا الأخرى (مثل نواة خلايا البشرة وخلايا لانغرهانس الليفية والطلائية) يمكنها استيعاب الدنا أيضا.[30][39] لم تكن هذه الظاهرة محل موضوعا لكثير من الدراسات ولذا فإن الآلية الفعلية لامتصاص الدنا ما زالت غير معروفة.
هناك نظريتان معروفتان في هذا الصدد، إما أن امتصاص الدنا في الكائنات الحية يحدث بشكل غير محدد بطريقة تشبه البلعمة أو الرشف الخلوي[12] أو عن طريق مستقبلات محددة.[40] قد يشمل هذا مستقبل سطح الخلية لبروتين 30kDa أو مستقبلات الخلايا البلعميّة الزبالة. مستقبل سطح الخلية لبروتين 30kDa يرتبط بالتحديد مع شظايا دنا جينومية بضغط دم يساوي 4500 (والتي يتم استيعابها فيما بعد) وتوجد في الخلايا المقدمة للأنتجينAPC وخلايا T المتخصصة. ترتبط مستقبلات الخلايا الملتهمة الزبالة بجزيئات مختلفة تشمل عديدات ريبونوكليوتيدات وبذا فهي عرضة لامتصاص الدنا.[40][41] امتصاص الدنا عبر المستقبلات يمكن تسهيله بواسطة حضور سلاسل عديد الغوانيلات. ربما يبدو المزيد من البحث في هذا الموضوع عديم الجدوى على اعتبار أن أنظمة الإيصال باستخدام مدفع الجين وتغليف الحويصلات الكاثودية (الموجبة) وطرق التوصيل الأخرى تتجاوز طريقة الإدخال هذه، ولكن قد يكون فهمها مفيدا في تقليص الكلفة (مثال: تقليل الحاجة إلى السايتوفيكتينات) وهو ما يشكل أهمية في صناعة علف الحيوانات.
تقديم المُسْتَضَد بواسطة الخلايا الناشئة في النخاع الشوكي

أظهرت الدراسات التي تستخدم الفئران المعدلة هندسيا في تركيبها (تعرف أيضا بالكمير)؛ أن المستضد يتم تقديمه بواسطة الخلايا التي نشأت في النخاع الشوكي والتي تشمل الخلايا التغصنيّة والخلايا الملتهمة واللمفاويات البائية المتخصصة والتي تسمى الخلايا المتخصصة العارضة للمستضد.[33][42] بعد تطعيم المدفع الجيني في الجلد تهاجر خلايا لانغرهانس إلى العقد الليمفاوية المصرِّفَة لتقدّم المستضد فيها. بعد حقن IM و ID وجد بأن الخلايا التغصنية تقدم أيضا المستضد في العقد الليمفاوية المصرفة فيما وجدت الخلايا المقطعية الملتهمة في الدم المحيطي.
إضافة إلى المقطعية المباشرة للخلايا التغصنية أو الملتهمة، من المعروف أن التَّرَأُس المتقاطع يحدث أيضا بعد IM, ID وإيصال الدنا عن طريق المدفع الجيني. يحصل التَّرَأُس المتقاطع عندما تقدّم الخلايا التي نشأت في النخاع الشوكي ببتيدات من بروتينات تم توليفها في خلية أخرى في سياق MHC من النمط 1. يستطيع هذا تجهيز استجابات الخلايا التائية السميّة ويبدو مهما لتحقيق استجابة مناعية أوليّة كاملة.[1][43]
دور الموقع المستهدف
يبدأ إيصال الدنا بواسطة IM و ID استجابة مناعية بطرق مختلفة. تقوم نواة خلايا البشرة وخلايا لانغرهانس الليفية والطلائية الموجودة في الجلد بالامتصاص وتقديم المستضد وهي مسؤولة عن حث استجابة أولية للمستضد. خلايا لانغرهانس المَعْدَيَّة تهاجر خارج الجلد (في غضون 12 ساعة) إلى العقد الليمفية المصرّفة حيث تجهز استجابات الليمفيات البائية الثانوية والخلايا التائيّة. في من جهة أخرى فإن خلايا العضلات المخططة في العضلات الهيكليّة عادة ما يتم تعداؤها، ولكن يبدو أنها غير مهمة في تصعيد استجابة مناعية. بدلا من ذلك، فإن الدنا المطعّم بواسطة IM «يغسل» في العقد الليمفاوية المصرّفة خلال دقائق، في حين يتم تعداء الخلايا التغصنيّة الطرفيّة ومن ثم تنشئ هذه الخلايا استجابة مناعية. يبدو أن خلايا العضلة القلبية تعمل كـ«ذخيرة» للمستضد لتهريب خلايا APC المتخصصة.[12][37][43]
المحافظة على الاستجابة المناعية
تنتج لقاحات الدنا ذاكرة مناعية فعالة بواسطة عرض معقدات المستضد-الجسم المضاد على خلايا متغصنة جريبية (بالإنجليزية: FDC), والتي هي محفزات ليمفياويات بائية قوية. يمكن تحفيز الخلايا التائية عن طريق خلايا تغصنية جنينية مشابهة. يمكن لـ FDC توليد ذاكرة مناعية بسبب «تداخل» إنتاج الأجسام المضادة مع التعبير طويل المدى للمستضد بحيث تسمح للمعقدات المناعية للمستضد-الجسم المضاد بأن تتشكل وتعرض من خلال FDC.[1]
الإنترفرونات
تتحكم الخلايا التائية السامة والمساعدة بالعدوى الفيروسية عن طريق إفراز مضادات الفيروسات.غالبا ما تفتل الخلايا التائية السامة الخلايا التي أصيبت بالعدوى الفيروسية. على أي حال يمكن حثها لإفراز سايتوكينات مضادة للفيروسات مثل INF-γ و TNF-α والتي لا تقتل الخلية ولكن تضع حدودا صارمة على العدوى الفيروسية عن طريق خفض تنظيم تعبير المكونات الفيروسية.[44] وهكذا يمكن استخدام لقاحات الدنا لكبح الإصابات الفيروسية عن طريق استخدام سيطرة IFN المتوسطة غير المدمرة وتم إثبات ذلك في حالة فيروس الكبد ب.[45] كما أن فيروس IFN-γ هو مهم أيضا في التحكم بعدوى الملاريا،[46] ويجب أخذه بالاعتبار عند تطوير لقاحات الدنا المضادة للملاريا.
تعديل الاستجابة المناعية
تعديل السايتوكينات
لكي يكون اللقاح فعالا يجب أن ينتج استجابة مناعية مناسبة لمسبب مرض محدد وقدرة لقاح الدنا على بلمرة الخلايا التائية المساعدة تجاه سجل TH1 أو TH2 وإنتاج CTL و/أو جسم مضاد عند اللزوم مما يشكل فائدة عظمى في هذا الصدد. يمكن تحقيق ذلك عن طريق تعديل نموذج مولد الضد المعبَّر عنه (مثال: خلوي مقابل مفرز) وطريقة ومسار التوصيل وجرعة الدنـا التي تم إيصالها.[25][26][47][48][49]
على أية حال، فيمكن تحقيق ذلك عن طريق مشاركة الإشراف على الدنا البلازميدي الذي يشفّر جزيئات المناعة التنظيمية مثل السايتكونات والليمفونيكات أو الجزيئات المساعدة للتنبيه. يمكن إدارة هذه «المواد الجينية المساعدة» بعدة طرق:
- كخليط من بلازميدين منفصلين، أحدهما يشفّر الـمستمنع فيما الآخر يشفّر السايتوكين.
- كناقل وحيد ثنائي أو متعدد السيسترونات مفصول بمناطق فاصلة أو
- ككمير مشفر البلازما أو بروتين التحام.
عموما فإن العوامل الالتهابية المساعدة للإشراف (مثل الإنترلوكينات وعامل النخر الورمي ومحفزات إعمار الخلايا المحببة والملتهمة (GM-CSF)(بالإضافة إلى الايتوكينات المنتجة لخلايا TH2 ترفع من استجابات مضادات الأجسام فيما تقوم العوامل الالتهابية والسايتوكينات المنتجة لخلايا TH1 بخفض الاستجابة الخلطية وزيادة استجابات السايتوكينات (وهي الأكثر أهمية في حالة الحماية من الفيروسات على سبيل المثال). تستخدم الجزيئات المساعدة للتنبيه مثل B7-1 و B7-2 و CD40L في بعض الأحيان أيضا.
تم تطبيق هذا المبدأ بنجاح في الإدارة الموضوعية لترميز لدنا البلازميدي IL-10.[20] البلازميد المشفر B7-1 (دواء على APCs) حسّن بنجاح الاستجابة المناعية في نماذج مضادات الورم ومزج البلازميدات المشفرة لـ GM-CSF وبروتينات غلاف الحيوان البوغي لـ P.
قام yoelii (PyCSP) بتحسين الحماية ضد التحديات المتعاقبة (في حين فشل PyCSP المشفر بلازميديا في ذلك). اقترح أنه ربما يتسبب GM-CSF في تقديم الخلايا التغصنية للمستضد بشكل أكثر فعالية ويحسن من إنتاج IL-2 وتفعيل خلية TH مما يؤدي بالتالي إلى تحريك الاستجابة المناعية المتزايدة.[34] يمكن تحسين هذا أكثر بواسطة العامل الأولي باستخدام مزيج من pPyCSP و pGM-CSFوالحقن لاحقا بفيروسات جدرية مطعمة تعبر عن PyCSP.[50] على أي حال فالمشاركة بحقن البلازميدات التي ترمز GM-CSF (أو IFN-γ أو IL-2) والتحام البروتين من P. بروتين سطح الميروزويت شابودي رقم 1 (النهاية الكربونية) وسطح فيروس بروتين التهاب الكبد ب (PcMSP1-HBs) يلغي فعليا الحماية ضد التحدي مقارنة بالحماية المكتسبة عن طريق إيصال pPcMSP1-HBs لوحدهـا.[17]
فوائد استخدام المواد المساعدة هي كلفتها المنخفضة وبساطة إدارتها وتجنب السايتكوينات المطعمة غير المستقرة والتي يحتمل أن تكون سامة، العوامل المساعدة «الاصطلاحيّة» (مثل الشب وفوسفات الكالسيوم والدهن أحادي الفسفور A وتوكسين الكوليرا والحويصلات الكاثودية (الموجبة) وحويصلات مان-المغلّفة و QS21 وكاربوكسي مثيل سللوز الكالسيوم (carboxymethylcellulose) وأوبينيميكس (ubenimix)).[1][12] ومع ذلك فإن السميّة المحتملة لتعبير السايتوكين الممتد لم يتم تأكيدها في أنواع حيوانية عديدة ومهمة تجاريا فما زالت الجينات السايتوكينية بحاجة إلى أن يتم تعريفها وعزلها. إضافة إلى ذلك، فإن السايتوكنات المشفرة البلازميد المتعددة تعدل نظام المناعة بطرق مختلفة تبعا لوقت الإيصال. مثلا، بعض سايتكونات الدنا البلازميدي يتم إيصالها على النحو الأمثل بعد توليد مستمنع الدنا البلازميدي وذلك لأن الإيصال السابق أو مشاركة الإيصال من الممكن فعليا أن تخفض من استجابة معينة وتزيد من استجابات غير محددة.[51]
لَبِنات CpG لتنشيط المناعة
يبدو أن الدنا البلازميدي بحد ذاته له تأثير مساعد على نظام المناعة؛[1][2] حيث وجد أن الدنا المشتق على نحو بكتيري يحرك آليات الدفاع المناعي وتنشيط الخلايا التغصنية وإنتاج سايتوكينات خلايا TH1.[29][52] ويحدث هذا بسبب ملاحظة سلاسل ثنائي النوكليوتيد CpG معينة والتي تحفز المناعة.[48][53]
تتكرر متواليات CpG التنشيطية (تعرف بـ CpG-S) أكثر بعشرين مرة في الدنا المشتق على نحو بكتيري من حقيقيات النواة. وذلك لأن حقيقات النواة تعرض «إخماد CpG»-مثال: أزواج ثنائي النوكليوتيد تحدث أقل بكثير من المتوقع. زيادة على ذلك، فإن سلاسل CpG-S هي تحت مثـْيَلة hypomethylated . عادة ما يحدث هذا في الدنا البكتيري بينما لبناتCpG التي تحدث في حقيقيات النواة هي مميثلة جميعها في نيوكليوتيدات السيتوزين. على العكس من ذلك، سلاسل النيوكليوتيدات التي تمنع تنشيط الاستجابة المناعية (تدعى بالـ CpGالمعادلة أو CpG-N) يتم تمثيلها أكثر في الجينومات حقيقية النواة.[54] وجد أن سلسلة تحفيز المناعة المثالية هي عبارة عن ثنائي نوكليوتيد CpG غير مميثلة محاطة ب اثنين من بيورينات 5’ واثنين من البيرميدينات رقم 3’.[48][52] كما أن المناطق المرافقة خارج سداسي تحفيز المناعة هذا ليكون غنيا بالجوانين لتأكيد الربط والامتصاص في الخلايا الهدف.
يعمل النظام الفطري بالتآزر مع النظام المناعي المساعد لجبل استجابة ضد بروتين الدنا المشفر. تنتج سلاسل CpG-S تنشيطا لخلايا (ب) متعددة النسيلة وتنظيم تعبير السايتوكونات وإفرازها.[55] تفرز الخلايا الملتهمة المحفزة IL-12, IL-18, TNF-α, IFN-α, IFN- و IFN-γ بينما تفرز خلايا (ب) المحفزة IL-6 وبعض IL-12.[12][55][56] يمكن أن يضمن التلاعب بسلاسل CpG-S وسلاسل CpG-N في العمود الفقري البلازميدي للقاح الدنا نجاح الاستجابة المناعية للمستضد المناعي ويقود الاستجابة المناعية تجاه النمط الظاهري لخلايا TH1. يصبح هذا مفيدا إذا احتاج مسبب المرض استجابة لخلايا TH بغرض الوقاية. استخدمت سلاسل CpG-S أيضا كمساعدات خارجية لكل من الدنا وتلقيح البروتين المطعم بمعدلات نجاح متفاوتة. كائنات حية أخرى بلبنات CpG ممـثـْيَلة أظهرت أيضا توسع تعبير خلايا ب متعددة النسيلة. على أي حال فإن الآلية وراء هذا قد تكون أكثر تعقيدا من مثـْيَلة -تحت مثـْيَلة لدنا الفئران لم يثبت جبلها لاستجابة مناعية.
معظم الأدلة على وجود سلاسل CpG المحفزة مناعيا تأتي من دراسات مسبب التيفوس الفأري. من الواضح أن استقراء هذه المعطيات على أنواع أخرى يجب أن يتم بحذر فالأنواع المختلفة قد يلزمها سلاسل مرافقة أخرى كالربط مع خصوصيات مستقبلات الخلايا الزبالة التي تختلف من نوع لآخر. زيادة إلى ذلك فأنواع مثل الحيوانات المجترة قد تكون غير حساسة لسلاسل التحفيز المناعي تبعا لعبء الجهاز الهضمي الكبير الذي تبديه. قد تكون مزيد من الدراسات مفيدة في تحسين تلقيح الدنا خصوصا في صناعة أغذية الحيوانات.
الدعائم البديلة
يمكن تعزيز الاستجابة المناعية للدنا المرأس عن طريق الإشراف على البروتين المطعم أو فيروسات الجدري المطعّمة. استراتيجيات «تعزيز-الرئيس» مع البروتين المطعم نجحت بزيادة كل من معادلة الجسم المضاد (titre) وجشع الجسم المضاد وثباته للمستمنعات الضعيفة مثل البروتين المغلف لفيروس HIV-1.[1][57] تم إثبات أن زيادات الفيروس المطعم فعالة جدا في تعزيز استجابات خلايا CTL للدنا المرأس. يركز الترأيس باستخدام الدنا الاستجابة المناعية على المستمنع المطلوب، بينما التعزيز بالفيروس المطعم يعطي كمية أكبر من المستضد المعبر عنه مما يؤدي لزيادة كبيرة في استجابات مخصوصة لخلايا CTL.
استراتيجيات تنشيط الترأس كانت ناجحة في إنتاج الوقاية ضد تحدي الملاريا في عدد من الدراسات. الفئران المرأسة التي تحوي دنا بلازميديا يشفر سطح غلاف البروتين الحيوان البوغي المتصورة (بلازميدية) لـ yoelii(PyCSP), ومن ثم تنشط بلقاح فيروسي مطعم يعبر عن نفس البروتين ويحوي مستويات أعلى من الجسم المضاد بصورة ملحوظة. نشاط الـ CTL و IFN-γ ومن ثم مستويات أعلى من الحماية من تلك التي تم تحصينها وتنشيطها عن طريق الدنا البلازميدي وحده.[58] يمكن تحسين ذلك أكثر عن طريق الترأس بخليط من البلازميدات المشفرة PyCSP والتيفوس الفأري قبل التنشيط بفيروس اللقاح المطعم.[50] تم إثبات إستراتيجية تنشيط ترأس فعالة لنموذج P. knowlesi للملاريا القردية.[59] تم رأس قرود الربص بلقاح دنا متعدد المركبات والمستويات يرمّز مستضدات مرحلة الكبد الثانية وبروتين سطح غلاف الحيوان البوغي (PkCSP) وبروتين سطح الحيوان البوغي رقم 2 (PkSSP2) واثنين من مستضدات مرحلة الدم وبروتين سطح المتصوّرة القميّة رقم 1 (PkMSP1p42). تم تعزيزها فيما بعد بفيروس جدري الكناريا المطعم مرمزا كل المستضدات الأربعة (ALVAC-4. طورت القرود المطعمّة مستضدات ضد الحيوانات البوغية والكريات الحمراء المصابة واستجابة الخلايا التائية المفرزة من نوع IFN-γ ضد بيبتيدات من PkCSP. تم تحقيق الحماية الجزئية ضد اختبار الحيوان البوغي وتم تقليل متوسط التسمم الدموي الطفيلي بشكل ملحوظ مقارنة بالتحكم بالقرود. بينما لا تكون هذه النماذج مثالية في حالة استقراء البلازميد المنجلي في حالة الإنسان إلا أنها مهمة في الاختبارات ما قبل السريرية.
تركيبات من الحمض النووي
يمكن تحسين فعالية مناعة الدنا عن طريق تثبيت الدنا ضد التحلل الحيوي وزيادة فعالية إيصال الدنا إلى خلايا تقديم المُسْتَضَد.[1] تم إثبات هذا عن طريق تغليف الحويصلات الكاثودية القابلة للتحلل (مثل متعدد (lactide-co-glycolide) موضوعة مع بروميد سيتيل ثلاثي ميثيل الأمونيوم بالإنجليزية cetyltrimethylammonium bromide) مع الدنا. مثل حويصلات الدنا المغلفة هذه يمكن أن تكون فاعلة في رفع استجابة CTL كفيروسات الوقس المطعمة خصوصا عند خلطها مع الشّب؛ ويبدو أن الجسيمات التي يبلغ قطرها 300 نانو مترا هي الأكثر فعاليّة للامتصاص بواسطة الخلايا العارضة (المقدِّمة) للمُسْتَضَد.[1]
نواقل الفيروسات الألفاويّة
استخدمت نواقل الناشئة عن فيروسات ألفا المعاد صياغتها وراثيا لتحسين فعالية تلقيح الدنـا.[1] يتم إدخال ترميز جين المستضد ذي العلاقة إلى ناسخ فيروسات ألفا بحيث تستبدل الجينات التركيبية فيما تترك الجينات المكرّرة وغير التركيبية دون أن تمس. استخدم كل من فيروس سن دبس وفيروس غابة سيمليكي لبناء ناسخات فيروسات ألفا المعاد صياغتها وراثيا.
بعكس لقاحات الدنا التقليدية، فإن نواقل فيروسات ألفا تقتل الخلايا المَعْدَيَّة وتقدّم بشكل عابر فقط. كما أن جينات فيروسات ألفا المكررة يعبر عنها إضافة إلى إدخال اللقاح. ومع أنه ليس من الواضح الكيفية التي تثير فيها مكرِّرات فيروسات ألفا الاستجابة المناعية، إلا أنه يعتقد أن هذا قد يكون بسبب مستويات تعبير البروتين العالية من خلال هذا الناقل، تؤدي استجابات السايتوكين المستحث عن طريق المكرّر أو موت الخلايا المبرمج والمستَحَث عن طريق المكرر إلى امتصاص محسّن لمولد الضد عن طريق الخلايا التغصنيّة.
انظر أيضًا
مراجع
- Robinson HL, Pertmer TM (2000)، "DNA vaccines for viral infections: basic studies and applications"، Adv. Virus Res.، 55: 1–74، doi:10.1016/S0065-3527(00)55001-5، PMID 11050940.
- Alarcon JB, Waine GW, McManus DP (1999)، "DNA vaccines: technology and application as anti-parasite and anti-microbial agents"، Adv. Parasitol.، 42: 343–410، doi:10.1016/S0065-308X(08)60152-9، PMID 10050276.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Tang, D. (1992)، "Genetic immunization is a simple method for eliciting an immune response"، Nature، 356 (6365): 152–154، doi:10.1038/356152a0، PMID 1545867.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Barnes, Kirsty (07 يونيو 2004)، "First positive results for DNA-based flu vaccine"، in-PharmaTechnologist، مؤرشف من الأصل في 22 أبريل 2008.
- "Fort Dodge Animal Health Announces Approval of West Nile Virus DNA Vaccine for Horses"، PR Newswire، 18 يوليو 2005، مؤرشف من الأصل في 04 سبتمبر 2012، اطلع عليه بتاريخ 21 نوفمبر 2007.
- "CDC and Fort Dodge Animal Health Achieve First Licensed DNA Vaccine"، CDC، 18 يوليو 2005، مؤرشف من الأصل في 20 أغسطس 2007، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Stuve, O. (2007)، "DNA Plasmid Vaccination for Multiple Sclerosis"، Archives of Neurology، 64 (10): 1385، doi:10.1001/archneur.64.10.1385، PMID 17923622، مؤرشف من الأصل في 28 مارس 2016.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Sedegah, M. (1994)، <9866:PAMBIW>2.0.CO;2-3/ "Protection against Malaria by Immunization with Plasmid DNA Encoding Circumsporozoite Protein"، Proceedings of the National Academy of Sciences of the United States of America، 91 (21): 9866–9870، doi:10.1073/pnas.91.21.9866، PMC 44918، PMID 7937907، مؤرشف من <9866:PAMBIW>2.0.CO;2-3 الأصل في 23 مايو 2020، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Mor, G.؛ Klinman؛ Shapiro؛ Hagiwara؛ Sedegah؛ Norman؛ Hoffman؛ Steinberg (15 أغسطس 1995)، "Complexity of the cytokine and antibody response elicited by immunizing mice with Plasmodium yoelii circumsporozoite protein plasmid DNA"، The Journal of Immunology، 155 (4): 2039–2046، PMID 7636255، مؤرشف من الأصل في 26 يوليو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Leitner, W.W.؛ Seguin؛ Ballou؛ Seitz؛ Schultz؛ Sheehy؛ Lyon (15 ديسمبر 1997)، "Immune responses induced by intramuscular or gene gun injection of protective deoxyribonucleic acid vaccines that express the circumsporozoite protein from Plasmodium berghei malaria parasites"، The Journal of Immunology، 159 (12): 6112–6119، PMID 9550412، مؤرشف من الأصل في 12 مايو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Böhm, W. (1996)، "DNA vector constructs that prime hepatitis B surface antigen-specific cytotoxic T lymphocyte and antibody responses in mice after intramuscular injection"، Journal of Immunological Methods، 193 (1): 29–40، doi:10.1016/0022-1759(96)00035-X، PMID 8690928، مؤرشف من الأصل في 14 أبريل 2020، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Lewis, P.J. (1999)، "DNA Vaccines: A Review"، Advances in Virus Research، Academic Press، 54: 129، doi:10.1016/S0065-3527(08)60367-X، ISBN 9780120398546، PMID 10547676، مؤرشف من الأصل في 13 مارس 2020، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Andre, S. (1 فبراير 1998)، "Increased Immune Response Elicited by DNA Vaccination with a Synthetic gp120 Sequence with Optimized Codon Usage"، Journal of Virology، 72 (2): 1497، PMC 124631، PMID 9445053، مؤرشف من الأصل في 28 سبتمبر 2011، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Muthumani, K. (2003)، "Novel engineered HIV-1 East African Clade-A gp160 plasmid construct induces strong humoral and cell-mediated immune responses in vivo"، Virology، 314 (1): 134، doi:10.1016/S0042-6822(03)00459-8، PMID 14517067، مؤرشف من الأصل في 2 مايو 2009، اطلع عليه بتاريخ 27 مارس 2008.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Rodriguez, F. (1997)، "DNA immunization: ubiquitination of a viral protein enhances cytotoxic T-lymphocyte induction and antiviral protection but abrogates antibody induction."، Journal of Virology، 71 (11): 8497، PMC 192313، PMID 9343207.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Tobery, T.W. (1997)، "Targeting of HIV-1 Antigens for Rapid Intracellular Degradation Enhances Cytotoxic T Lymphocyte (CTL) Recognition and the Induction of De Novo CTL Responses In Vivo After Immunization"، Journal of Experimental Medicine، 185 (5): 909–920، doi:10.1084/jem.185.5.909، PMC 2196169، PMID 9120397.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Wunderlich, G. (2000)، "Genetic Immunization of BALB/c mice with a Plasmid Bearing the Gene Coding for a Hybrid Merozoite Surface Protein 1-Hepatitis B Virus Surface Protein Fusion Protects Mice against Lethal Plasmodium chabaudi chabaudi PC1 Infection"، Infection and Immunity، 68 (10): 5839، doi:10.1128/IAI.68.10.5839-5845.2000، PMC 101545، PMID 10992493.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Weiner, D.B. (1999)، "Genetic vaccines"، Scientific American، 281 (1): 34–41، مؤرشف من الأصل في 23 مايو 2020، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) نسخة محفوظة 25 مارس 2009 على موقع واي باك مشين. - Widera, G. (1 مايو 2000)، "Increased DNA Vaccine Delivery and Immunogenicity by Electroporation In Vivo"، The Journal of Immunology، 164 (9): 4635–4640، PMID 10779767، مؤرشف من الأصل في 2 يونيو 2018، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Daheshia, M.؛ Kuklin؛ Kanangat؛ Manickan؛ Rouse (15 أغسطس 1997)، "Suppression of ongoing ocular inflammatory disease by topical administration of plasmid DNA encoding IL-10"، The Journal of Immunology، 159 (4): 1945–1952، PMID 9257860، مؤرشف من الأصل في 6 ديسمبر 2007، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Chen, Y. (1 مارس 1998)، "Induction of CD8+ T Cell Responses to Dominant and Subdominant Epitopes and Protective Immunity to Sendai Virus Infection by DNA Vaccination 1"، The Journal of Immunology، 160 (5): 2425–2432، PMID 9498786، مؤرشف من الأصل في 11 أغسطس 2010، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Sizemore DR, Branstrom AA, Sadoff JC (أكتوبر 1995)، "Attenuated Shigella as a DNA delivery vehicle for DNA-mediated immunization"، Science (journal)، 270 (5234): 299–302، doi:10.1126/science.270.5234.299، PMID 7569980، مؤرشف من الأصل في 14 مايو 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fynan, E.F. (1993)، "DNA vaccines: protective immunizations by parenteral, mucosal, and gene-gun inoculations"، Proc Natl Acad Sci USA، 90 (24): 11478–82، doi:10.1073/pnas.90.24.11478، PMC 48007، PMID 8265577.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Barry, M.A. (1995)، "Protection against mycoplasma infection using expression-library immunization"، Nature، 377 (6550): 632–635، doi:10.1038/377632a0، PMID 7566175.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Feltquate, D.M.؛ Heaney؛ Webster؛ Robinson (1 مارس 1997)، "Different T helper cell types and antibody isotypes generated by saline and gene gun DNA immunization"، The Journal of Immunology، 158 (5): 2278–2284، PMID 9036975، مؤرشف من الأصل في 22 أكتوبر 2010، اطلع عليه بتاريخ 21 نوفمبر 2007.
- References, S. (1996)، "Role of different lymphoid tissues in the initiation and maintenance of DNA-raised antibody responses to the influenza virus H1 glycoprotein."، J Virol، 70 (12): 9074–8، PMC 191015، PMID 8971047.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Sällberg, M. (1997)، "Characterization of humoral and CD4+ cellular responses after genetic immunization with retroviral vectors expressing different forms of the hepatitis B virus core and e antigens."، Journal of Virology، 71 (7): 5295، PMC 191766، PMID 9188598.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Banchereau, J. (1998)، "Dendritic cells and the control of immunity"، Nature، 392 (6673): 245–252، doi:10.1038/32588، PMID 9521319.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Jakob, T. (15 سبتمبر 1998)، "Activation of Cutaneous Dendritic Cells by CpG-Containing Oligodeoxynucleotides: A Role for Dendritic Cells in the Augmentation of Th1 Responses by Immunostimulatory DNA 1"، The Journal of Immunology، 161 (6): 3042–3049، PMID 9743369، مؤرشف من الأصل في 14 أبريل 2020، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Raz, E. (1996)، "Preferential induction of a Th1 immune response and inhibition of specific IgE antibody formation by plasmid DNA immunization"، Proc Natl Acad Sci US A، 93 (10): 5141–5، doi:10.1073/pnas.93.10.5141، PMC 39421، PMID 8643542.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Fu TM, Friedman A, Ulmer JB, Liu MA, Donnelly JJ (1 أبريل 1997)، "Protective cellular immunity: cytotoxic T-lymphocyte responses against dominant and recessive epitopes of influenza virus nucleoprotein induced by DNA immunization"، J. Virol.، 71 (4): 2715–21، PMC 191393، PMID 9060624، مؤرشف من الأصل في 14 مايو 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Restifo, N.P.؛ Bacík؛ Irvine؛ Yewdell؛ McCabe؛ Anderson؛ Eisenlohr؛ Rosenberg؛ Bennink (1 مايو 1995)، "Antigen processing in vivo and the elicitation of primary CTL responses"، The Journal of Immunology، 154 (9): 4414–22، PMC 1952186، PMID 7722298، مؤرشف من الأصل في 26 يوليو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Iwasaki, A.؛ Stiernholm؛ Chan؛ Berinstein؛ Barber (15 مايو 1997)، "Enhanced CTL responses mediated by plasmid DNA immunogens encoding costimulatory molecules and cytokines"، The Journal of Immunology، 158 (10): 4591–4601، PMID 9144471، مؤرشف من الأصل في 6 ديسمبر 2007، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Weiss, W.R. (1 سبتمبر 1998)، "A Plasmid Encoding Murine Granulocyte-Macrophage Colony-Stimulating Factor Increases Protection Conferred by a Malaria DNA Vaccine 1"، The Journal of Immunology، 161 (5): 2325–2332، PMID 9725227، مؤرشف من الأصل في 13 أغسطس 2010، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Tsuji, T.؛ Hamajima؛ Fukushima؛ Xin؛ Ishii؛ Aoki؛ Ishigatsubo؛ Tani؛ Kawamoto (15 أبريل 1997)، "Enhancement of cell-mediated immunity against HIV-1 induced by coinnoculation of plasmid-encoded HIV-1 antigen with plasmid expressing IL-12"، The Journal of Immunology، 158 (8): 4008–4013، PMID 9103472، مؤرشف من الأصل في 28 مايو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Justewicz, D.M. (1996)، "Long-Term Maintenance of B Cell Immunity to Influenza Virus Hemagglutinin in Mice Following DNA-Based Immunization"، Virology، 224 (1): 10–17، doi:10.1006/viro.1996.0501، PMID 8862394، مؤرشف من الأصل في 11 يناير 2019، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Wolff JA, Dowty ME, Jiao S؛ وآخرون (1 ديسمبر 1992)، "Expression of naked plasmids by cultured myotubes and entry of plasmids into T tubules and caveolae of mammalian skeletal muscle"، J. Cell. Sci.، 103 (Pt 4) (4): 1249–59، PMID 1487500، مؤرشف من الأصل في 14 مايو 2020.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Anderson RG, Kamen BA, Rothberg KG, Lacey SW (يناير 1992)، "Potocytosis: sequestration and transport of small molecules by caveolae"، Science، 255 (5043): 410–1، doi:10.1126/science.1310359، PMID 1310359، مؤرشف من الأصل في 14 مايو 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Casares S, Inaba K, Brumeanu TD, Steinman RM, Bona CA (نوفمبر 1997)، "Antigen presentation by dendritic cells after immunization with DNA encoding a major histocompatibility complex class II-restricted viral epitope"، J. Exp. Med.، 186 (9): 1481–6، doi:10.1084/jem.186.9.1481، PMC 2199124، PMID 9348305، مؤرشف من الأصل في 14 مايو 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bennett, R.M. (1985)، "DNA binding to human leukocytes. Evidence for a receptor-mediated association, internalization, and degradation of DNA"، J Clin Invest، 76 (6): 2182–90، doi:10.1172/JCI112226، PMC 424340، PMID 3001145.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Bennet, R.M.؛ Hefeneider؛ Bakke؛ Merritt؛ Smith؛ Mourich؛ Heinrich (1 مايو 1988)، "The production and characterization of murine monoclonal antibodies to a DNA receptor on human leukocytes"، The Journal of Immunology، 140 (9): 2937–42، PMID 2452195، مؤرشف من الأصل في 1 ديسمبر 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Corr, M.؛ Lee؛ Carson؛ Tighe (1996)، "Gene vaccination with naked plasmid DNA: mechanism of CTL priming"، Journal of Experimental Medicine، 184 (4): 1555–1560، doi:10.1084/jem.184.4.1555، PMC 2192808، PMID 8879229.
- Torres CA, Iwasaki A, Barber BH, Robinson HL (مايو 1997)، "Differential dependence on target site tissue for gene gun and intramuscular DNA immunizations"، J. Immunol.، 158 (10): 4529–32، PMID 9144463، مؤرشف من الأصل في 14 أبريل 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Franco, A.؛ Guidotti؛ Hobbs؛ Pasquetto؛ Chisari (15 أغسطس 1997)، "Pathogenetic effector function of CD4-positive T helper 1 cells in hepatitis B virus transgenic mice"، The Journal of Immunology، 159 (4): 2001–2008، PMID 9257867، مؤرشف من الأصل في 6 ديسمبر 2007، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Mancini, M. (1996)، "DNA-mediated immunization in a transgenic mouse model of the hepatitis B surface antigen chronic carrier state."، Proc Natl Acad Sci USA، 93 (22): 12496–501، doi:10.1073/pnas.93.22.12496، PMC 38020، PMID 8901610.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Doolan, D.L. (15 يوليو 1999)، "IL-12 and NK Cells Are Required for Antigen-Specific Adaptive Immunity Against Malaria Initiated by CD8+ T Cells in the Plasmodium yoelii Model 1"، The Journal of Immunology، 163 (2): 884–92، PMID 10395683، مؤرشف من الأصل في 29 أغسطس 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Cardoso AI, Blixenkrone-Moller M, Fayolle J, Liu M, Buckland R, Wild TF (نوفمبر 1996)، "Immunization with plasmid DNA encoding for the measles virus hemagglutinin and nucleoprotein leads to humoral and cell-mediated immunity"، Virology، 225 (2): 293–9، doi:10.1006/viro.1996.0603، PMID 8918915، مؤرشف من الأصل في 11 يناير 2019.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sato, Y. (1996)، "Immunostimulatory DNA Sequences Necessary for Effective Intradermal Gene Immunization"، Science، 273 (5273): 352، doi:10.1126/science.273.5273.352، PMID 8662521.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Weiss, R. (2000)، "Genetic Vaccination against Malaria Infection by Intradermal and Epidermal Injections of a Plasmid Containing the Gene Encoding the Plasmodium berghei Circumsporozoite Protein"، Infection and Immunity، 68 (10): 5914، doi:10.1128/IAI.68.10.5914-5919.2000، PMC 101554، PMID 10992502.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Sedegah, M. (1 يونيو 2000)، "Improving Protective Immunity Induced by DNA-Based Immunization: Priming with Antigen and GM-CSF-Encoding Plasmid DNA and Boosting with Antigen-Expressing Recombinant Poxvirus 1 2"، The Journal of Immunology، 164 (11): 5905–5912، PMID 10820272، مؤرشف من الأصل في 12 أكتوبر 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Barouch, D.H. (15 أغسطس 1998)، "Augmentation and Suppression of Immune Responses to an HIV-1 DNA Vaccine by Plasmid Cytokine/Ig Administration 1"، The Journal of Immunology، 161 (4): 1875–1882، PMID 9712056، مؤرشف من الأصل في 5 سبتمبر 2017، اطلع عليه بتاريخ 21 نوفمبر 2007.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Krieg, A.M. (1995)، "CpG motifs in bacterial DNA trigger direct B-cell activation"، Nature، 374 (6522): 546–549، doi:10.1038/374546a0، PMID 7700380.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Klinman, D.M.؛ Yamshchikov؛ Ishigatsubo (15 أبريل 1997)، "Contribution of CpG motifs to the immunogenicity of DNA vaccines"، The Journal of Immunology، 158 (8): 3635–3639، PMID 9103425، مؤرشف من الأصل في 28 مايو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Krieg, A.M. (1998)، "Sequence motifs in adenoviral DNA block immune activation by stimulatory CpG motifs"، Proceedings of the National Academy of Sciences of the United States of America، 95 (21): 12631، doi:10.1073/pnas.95.21.12631، PMC 22882، PMID 9770537.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Klinman, D.M. (1996)، "CpG motifs present in bacterial DNA rapidly induce lymphocytes to secrete interleukin 6, interleukin 12 and interferon-y"، Proc Natl Acad Sci USA، 93 (7): 2879–83، doi:10.1073/pnas.93.7.2879، PMC 39727، PMID 8610135.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Yi, A.K.؛ Chace؛ Cowdery؛ Krieg (15 يناير 1996)، "IFN-gamma promotes IL-6 and IgM secretion in response to CpG motifs in bacterial DNA and oligodeoxynucleotides"، The Journal of Immunology، 156 (2): 558–64، PMID 8543806، مؤرشف من الأصل في 20 يوليو 2008، اطلع عليه بتاريخ 21 نوفمبر 2007.
- Letvin, N.L. (1997)، "Potent, protective anti-HIV immune responses generated by bimodal HIV envelope DNA plus protein vaccination"، Proceedings of the National Academy of Sciences، 94 (17): 9378، doi:10.1073/pnas.94.17.9378، PMC 23198، PMID 9256490.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link) - Sedegah, M. (1998)، "Boosting with recombinant vaccinia increases immunogenicity and protective efficacy of malaria DNA vaccine"، Proc Natl Acad Sci USA، 95 (13): 7648–53، doi:10.1073/pnas.95.13.7648، PMC 22711، PMID 9636204.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Rogers, W.O. (2001)، "Multistage Multiantigen Heterologous Prime Boost Vaccine for Plasmodium knowlesi Malaria Provides Partial Protection in Rhesus Macaques"، Infection and Immunity، 69 (9): 5565، doi:10.1128/IAI.69.9.5565-5572.2001، PMC 98670، PMID 11500430.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)صيانة CS1: extra punctuation (link)
مصادر خارجية
- PowderMed pdf report
- DyNAVacS, an Integrative Tool for Optimised DNA Vaccine Design from the Institute of Genomics and Integrative Biology.
- Hooper JW, Thompson E, Wilhelmsen C؛ وآخرون (مايو 2004)، "Smallpox DNA vaccine protects nonhuman primates against lethal monkeypox"، J. Virol.، 78 (9): 4433–43، doi:10.1128/JVI.78.9.4433-4443.2004، PMC 387704، PMID 15078924، مؤرشف من الأصل في 23 مايو 2020.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة صيدلة
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة طب