ثنائي ببتيد
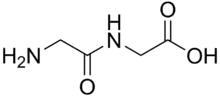
ثنائي الببتيد مركب عضوي مشتق من اثنين من الأحماض الأمينية . يمكن أن تكون الأحماض الأمينية المكونة هي نفسها أو مختلفة. عندما يكون هناك اختلاف ، يمكن أن يكون هناك إيزومرين من ثنائي الببتيد ، اعتمادًا على التسلسل. العديد من ثنائي الببتيدات مهمة من الناحية الفسيولوجية ، وبعضها مهم من الناحية الفسيولوجية والتجارية. من المعروف أن ثنائي الببتيد هو الأسبارتام ، وهو مُحلي صناعي.[1]
ثنائي الببتيدات هي مواد صلبة بيضاء. كثير منها أكثر قابلية للذوبان في الماء من الأحماض الأمينية الأصلية. على سبيل المثال ، يحتوي ثنائي الببتيد Ala-Gln على قابلية ذوبان تبلغ ٥٨٦ جم / لتر أكثر من ١٠ أضعاف قابلية ذوبان Gln (٣٥ جم / لتر). يمكن أن تظهر أيضًا ثباتات مختلفة ، على سبيل المثال فيما يتعلق بالتحلل المائي. Gln لا يتحمل إجراءات التعقيم ، في حين أن هذا ثنائي الببتيد لا يتحمل. نظرًا لأن الببتيدات عرضة للتحلل المائي ، يتم استغلال قابلية الذوبان العالية في الحقن ، أي لتوفير التغذية.
أمثلة

قيمة تجارية
حوالي ستة ديبيبتيدات ذات أهمية تجارية.[1]
- الأسبارتام ( N - L -α-aspartyl- L -phenylalanine 1-methyl ester) هو مُحلي صناعي.
- كارنوزين (بيتا -alanyl- L -histidine) و الوزي (بيتا -alanyl- N -methyl الحامض الاميني) تتركز بشكل كبير في العضلات والدماغ الأنسجة . يتم استخدامها في الأدوية الرياضية.
- أسيتيل كارنوزين ، منع إعتام عدسة العين
- Ala-Gln and Gly-Tyr ، تسريب [2]
- فال صور ، خافضة للضغط
الببتيدات الأخرى
- Homoanserine ( N - (4-aminobutyryl) - L -histidine) هو ثنائي ببتيد آخر تم تحديده في دماغ وعضلات الثدييات.
- Kyotorphin ( L -tyrosyl- L -arginine) هو ثنائي ببتيد نشط عصبي يلعب دورًا في تنظيم الألم في الدماغ.
- Balenine [バレニン] (أو الأفيدين) ( بيتا- ألانيل- N تاو- ميثيل هيستيدين) في عضلات عدة أنواع من الثدييات (بما في ذلك الإنسان) والدجاج .
- Glorin ( N -propionyl-γ- L -glutamyl- L -ornithine-δ-lac ethyl ester) هو ثنائي ببتيد كيميائي لعفن الوحل Polysphondylium violaceum .
- Barettin (cyclo - [(6-bromo-8-en-tryptophan) -arginine]) هو ثنائي ببتيد دوري من الإسفنج البحري Geodia barretti .
- بسودوبرولين
- يشيع استخدام الديالانين كنموذج في الديناميكيات الجزيئية .
إنتاج
ثنائي الببتيدات الاصطناعية
يتم إنتاج الببتيدات عن طريق اقتران الأحماض الأمينية. يتم تحويل المجموعة الأمينية الموجودة في حمض أميني واحد إلى مادة غير محبة للنواة ويتم إلغاء تنشيط مجموعة الأحماض الكربوكسيلية في الحمض الأميني الثاني باعتبارها إستر الميثيل الخاص بها. يتم بعد ذلك دمج الأحماض الأمينية المعدلة في وجود عامل اقتران ، مما يسهل تكوين رابطة الأميد:
- RCH (NHP) CO 2 H + R'CH (NH 2 ) CO 2 CH 3 → RCH (NHP) C (O) NH (CHR ') CO 2 CH 3 + H 2 O
بعد تفاعل الاقتران هذا ، يتم تحويل مجموعة حماية الأمين P والإستر إلى الأمين الحر وحمض الكربوكسيل ، على التوالي.[3]
بالنسبة للعديد من الأحماض الأمينية ، تكون المجموعات الوظيفية المساعدة محمية . يستخدم تكثيف الأمين والحمض الكربوكسيل لتكوين رابطة الببتيد عمومًا عوامل اقتران لتنشيط حمض الكربوكسيل.[4]
إن تخليق ببتيد بيرجمان أزلاكتون هو تخليق عضوي كلاسيكي لتحضير ثنائي الببتيدات.[1]
التخليق الحيوي
يتم إنتاج الببتيدات من عديد الببتيدات عن طريق عمل إنزيم هيدرولاز dipeptidyl peptidase .[5] يتم هضم البروتينات الغذائية إلى ثنائي الببتيدات والأحماض الأمينية ، ويتم امتصاص ثنائي الببتيدات بسرعة أكبر من الأحماض الأمينية ، لأن امتصاصها ينطوي على آلية منفصلة. تنشط الببتيدات الخلايا G الموجودة في المعدة لإفراز الجاسترين .
ديكيتوبيبرازين (ثنائي ببتيدات دورية)
Diketopiperazines هي فئة خاصة من ثنائي الببتيدات ، وهي دورية. أنها تشكل منتجات جانبية في تخليق الببتيد. تم إنتاج العديد من الأحماض الأمينية غير المتعارف عليها.[7]
المراجع
- Yagasaki, Makoto؛ Hashimoto, Shin-ichi (2008)، "Synthesis and application of dipeptides; current status and perspectives"، From Applied Microbiology and Biotechnology، 81 (1): 13–22، doi:10.1007/s00253-008-1590-3، PMID 18795289.
- Furst, Peter؛ Pogan, Karin؛ Stehle, Peter (1997)، "Glutamine dipeptides in clinical nutrition"، Nutrition، 13 (7–8): 731–7، doi:10.1016/S0899-9007(97)83035-3، PMID 9263278.
- Subirós-Funosas, Ayman El-Faham؛ Fernando Albericio (2013)، "Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe"، Org. Synth.، 90: 306، doi:10.15227/orgsyn.090.0306.
- Jean-Simon Suppo؛ Renata Marcia de Figueiredo؛ Jean-Marc Campagne (2015)، "Dipeptide Syntheses via Activated α-Aminoesters"، Org. Synth.، 92: 296–308، doi:10.15227/orgsyn.092.0296.
- Steane, Richard، "Hydrolysis of a dipeptide"، BioTopics، مؤرشف من الأصل في 14 نوفمبر 2020، اطلع عليه بتاريخ 28 يوليو 2014.
- Domling A, المحرر (يناير 2013)، "Retosiban and Epelsiban: Potent and Selective Orally available Oxytocin Antagonists"، Methods and Principles in Medicinal Chemistry: Protein-Protein Interactions in Drug Discovery، Weinheim: Wiley-VCH، ص. 225–256، ISBN 978-3-527-33107-9.
- Borthwick, A. D. (2012)، "2,5-Diketopiperazines: Synthesis, Reactions, Medicinal Chemistry, and Bioactive Natural Products"، Chem. Rev.، 112 (7): 3641–716، doi:10.1021/cr200398y، PMID 22575049.