حمض السيليسيك
حمض السيليسيك هو مركب كيميائي ، ويسمى أحيانا سيلانول . حمض السيليسيك هو اسم عام لعلئلة من مركبات تحتوي على السيليكون مرتبطا بأكسيد أو مرتبطا بمجموعة هيدروكسيل. لتلك المركبات الصيغة الكيميائية العامة [SiOx(OH)4-2x]n.[1][2] وقد تعرف العلماء على عدد من أحماض السيليسيك ولكنها جانت جميعها في محاليا مائية منخفضة التركيز جدا ، من أمثالها «حمض ميتاسيليسيك» (H2SiO3), وحمض أرثوسيليسيك (H4SiO4, pKa1=9.84, pKa2=13.2 at 25 °C), «وحمض ديسيليسيك» (H2Si2O5), و«حمض بيروسيليسيك» (H6Si2O7); ومن المحتمل أنه عند تجمد تلك الأحماض إنها تكوّن مركبات معقدة مبلمرة .
| حمض السيليسيك | |
|---|---|
 حمض السيليسيك | |
| الاسم النظامي (IUPAC) | |
Silicic acid | |
| أسماء أخرى | |
Monosilicic acid | |
| المعرفات | |
| رقم CAS | 10193-36-9 |
| بوب كيم (PubChem) | 14942 ? |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | H4O4Si |
| كتلة مولية | 96.11 غ.مول−1 |
| حموضة (pKa) | 9.84, 13.2 |
| مركبات متعلقة | |
| مركبات ذات علاقة | Orthocarbonic acid |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الصيغة الكيميائية العامة هي : SiO2 · n H2O ; حيث لا يكون الماء ماء تبلور ، وانما من الممكن أن ينفصل خلال تفاعلات كيميائية وتتكون مجموعات هيدروكسيل.
عندما يفقد «حمض أورثوسليكات» الماء فهو يتحول إل ثاني أكسيد السيليكون . وتسمى أملاح الحمض سيليكات .
كما من الممكن ان تتكون منه إستر عندما يتفاعل جزيء عضوي معه.
طبيعيا يوجد حمض السيليسيك في الأحفورات والترسيبات الجيولوجية ، وهي المادة الطبيعية في دروع بعض الطحالب ، ومنه الصناعي ويسمى «زجاج سليكوني» ، وصيغتهم العامة : SiO2 , أي أنهم جميعا ثاني أكسيد السيليكون.
تفاعلاته الكيميائية
تفاعلات حمض السيليسيك تكون بصفة عامة خارجة عن إطار السيطرة . يحدث له فقد للهيدروجين وينتج «حمض ميتاسيليسيك» ، ولا يستقر على ذلك بل يكمل التفاعل حتى ينتج ثاني أكسيد السيليكون وماء .
تفاعلات حمض-قلوي
مثل حمض السيليسيك هو مثل «السيلانول» فهو حمض ضعيف . يمكن نزع بروتون (أيون الهيدروجين) منه في محلول ، منتجا سليكات حمض مرافق .
وجوده
يوجد حمض السيليسيك الأحادي في جميع المياه ، وحتى في مياه الشرب ، وفي سوائل أجسام الحيوان والنبات . وتستغل طحالب السليكون حمض السيليسيك لتكوين دروعها . ويتعادل استهلاك حمض السيليسيك البيولوجي في البيئة عن طريق ماء الأمطار ومياه الرشح ، التي تتخلل التربة وتذيب حمض السيليسيك من سليكات التربة .
كما أن حمض السيليسيك هو الفعال في تكوين الأحفورات مثل تكوين الأشجار المتحجرة والغابات المتحجرة.
تحضيره
يحضر حمص السليسيك الأحادي عن طريق التحليل الكهربائي من محاليل هالوجينات السليكون مثل رابع فلوريد السليكون و رابع كلوريد السيليكون ، أو "تترا ميثيل أورثوسيليكات" .
في العوالق المائية يتحول ثاني أكسيد السيليكون SiO2 ببطء شديد إلى حمض السيليسيك الأحادي . وعند درجة حرارة 25 °C تذوب نحو 120 مليجرام من SiO2 في لتر واحد من الماء :
ويتكون حمض السيليسيك أيضا من ذوبان «ألكالي سيليكات» Alkalisilicate والذي يسمى احيانا «الزجاج المائي» في أحماض فلزات . وتتضمن الطريقة الصناعية تحضيره التبادل الكاتيوني بدلا من استخدام أحماض فلزات.
ذوبانــه
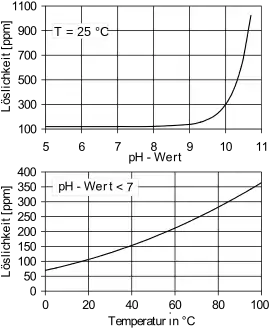
1زبان حمض السيليسليك في الماء ضعيف جدا ويسير ببطء شديد. عند باهاء 7 ودرجة حرارة 25 °C يذوب منه 0,12 جرام (في صورة أكسيد السيليكون ) في لتر واحد من الماء .
وبارتفاع درجة الحرارة وارتفاع الباهاء يرتفع بالتالي ذوبانه في الماء . فعند درجة حرارة 75 °C ; تبلغ نسبته 330 جزء في مليون جزء من الماء .[3][4]
توزيع حمض السيليسيك في البحار

يتكون حمض السيليسيك بالقرب من سطح المحيطات عن طريق تفاعل إماهة . وينتقل إلى الاعماق عن طريق سقوط المياه (الباردة ) عند القطبين . ويقوم العلماء بقياس معدلات وجود حمض السيليسيك في المحيطات والبحار ، حيث من الممكن أن يتغير تركيزه في المياه بفعل ما يقوم به الإنسان من أنشطة . وهو ينزع ابتدائيا عن طريق تحويله إلى ثاني أكسيد السيليكون وماء .
وفي المحيطات يتكون حمض السليسليك غالبا في هيئة حمض أورثو السيليسيك (H4SiO4), وتنتظم دورته البيولوجية (الحيوية) تحت فعل مجموعة من الطحالب تسمى دياتوم.[6][7]
تلك الطحالب تعمل على بلمرة حمض السيليسيك إلى «سيليكا حيوية» ، تدخل بدورها في بنية جدران خلايا الطحالب وتسمى «فروستولز».
المراجع
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- R. K. Iler, The Chemistry of Silica, Wiley, New York, 1979.
- J. Schlomach: Feststoffbildung bei technischen Fällprozessen. Dissertation, Universität Fridericiana Karlsruhe, 2006, ISBN 3-86644-024-3 S. 9. نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
- Z. Amjad: Water soluble polymers: solution properties and applications. Verlag Springer, 1998, ISBN 0-306-45931-0 ، صفحة. 173, في كتب جوجل.
- World Ocean Atlas 2009 نسخة محفوظة 07 يوليو 2017 على موقع واي باك مشين.
- Siever, R. (1991). Silica in the oceans: biological-geological interplay. In: Schneider, S. H., Boston, P. H. (eds.), Scientists On Gaia, The MIT Press, Cambridge MA, USA, pp. 287-295.
- Treguer, P., Nelson, D. M., Van Bennekom, A. J., DeMaster, D. J., Leynaert, A. and Queguiner, B. (1995). The silica balance in the world ocean: A reestimate. Science 268, 375-379. نسخة محفوظة 30 سبتمبر 2009 على موقع واي باك مشين.
- بوابة الكيمياء