رباعي فلوريد الكبريت
رباعي فلوريد الكبريت هو مركب كيميائي من عنصري الكبريت والفلور، له الصيغة الكيميائية SF4، ويكون على شكل غاز عديم اللون، له رائحة واخزة.
| رباعي فلوريد الكبريت | |
|---|---|
 رباعي فلوريد الكبريت | |
 رباعي فلوريد الكبريت |
 رباعي فلوريد الكبريت |
| الاسم النظامي (IUPAC) | |
Sulfur(IV) fluoride | |
| أسماء أخرى | |
Sulfur tetrafluoride | |
| المعرفات | |
| رقم CAS | 7783-60-0 |
| بوب كيم (PubChem) | 24555 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | SF4 |
| الكتلة المولية | 108.07 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 1.95 غ/سم3 (سائل عند −78 °س) |
| نقطة الانصهار | − 121 °س |
| نقطة الغليان | - 38 °س |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
حضر المركب لأول مرة سنة 1929 من قبل العالمين الألمانيين يوزيف فيشر Joseph Fischer و فيرنر ينكنر Werner Jaenckner من تفاعل فلوريد الكوبالت الثلاثي مع الكبريت.[3]
يحضر المركب حالياً من التفاعل المباشر بين عنصري الفلور والكبريت:[4]
يمكن استعمال عوضاً عن الفلور مركب ثلاثي كلورو فلورو الميثان.[5]
أما مخبرياً فيمكن أن تتم عملية التحضير من تفاعل ثنائي كلوريد الكبريت مع فلوريد الصوديوم:[4][6]
الخواص
يكون المركب على شكل غاز عديم اللون له رائحة واخزة في الشروط القياسية من الضغط ودرجة الحرارة، وهو يتفاعل بعنف مع الماء ويصدر حمض هيدروفلوريك المخرش.
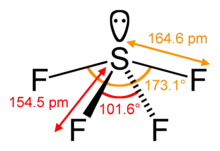
للمركب بنية جزيئية وفق الشكل المتأرجح (مثل شكل لعبة التوازن)، وذلك حسب نظرية فيسبر.
الاستخدامات
يستخدم مركب رباعي فلوريد الكبريت ككاشف مهم لتحضير مركبات فلوروكربون العضوية.[7]
كما أنه عامل مهم في الفلورة في الاصطناع العضوي، إذ يستخدم مثلاً من أجل تحويل مجموعات COH و C=O إلى CF و CF2 على الترتيب.[8]
طالع أيضاً
المراجع
- العنوان : SULFUR TETRAFLUORIDE — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/24555 — تاريخ الاطلاع: 5 أكتوبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/24555
- Joseph Fischer, Werner Jaenckner (1929)، "Eine neue Fluor-Schwefelverbindung, das Schwefel-4-fluorid (vorläufige Mitteilung"، Zeitschrift für Angewandte Chemie، 42 (31): 810–811، doi:10.1002/ange.19290423105.
- Georg Brauer; Handbuch der Präparativen Anorganischen Chemie, Band 1, ISBN 3-432-02328-6, S. 183–184.
- D. Naumann 1, Dr. (Mrs.) D. K. Padma: Die Darstellung von Schwefeltetrafluorid aus den Elementen bei tiefer Temperatur in einem inerten Lösungsmittel. In: Zeitschrift für anorganische und allgemeine Chemie. 1973, 401, 1, S. 53–56, دُوِي:10.1002/zaac.19734010108.
- F. S. Fawcett, C. W. Tullock, "Sulfur (IV) Fluoride: (Sulfur Tetrafluoride)" Inorganic Syntheses, 1963, vol. 7, pp 119–124. دُوِي:10.1002/9780470132388.ch33
- C.-L. J. Wang, "Sulfur Tetrafluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. دُوِي:10.1002/047084289.
- Hasek, W. R.."1,1,1-Trifluoroheptane". Org. Synth.; Coll. Vol. 5: 1082.
- بوابة الكيمياء