كلوريد القصدير الرباعي
كلوريد القصدير الرباعي (أو رباعي كلوريد القصدير) مركب كيميائي له الصيغة الكيميائية SnCl4، ويكون في الشروط القياسية من الضغط ودرجة الحرارة على شكل سائل عديم اللون.
| كلوريد القصدير الرباعي | |
|---|---|
_chloride_pentahydrate.jpg.webp) كلوريد القصدير الرباعي |
_chloride.jpg.webp) كلوريد القصدير الرباعي |
 كلوريد القصدير الرباعي |
-chlorid.svg.png.webp) كلوريد القصدير الرباعي |
| الاسم النظامي (IUPAC) | |
Tetrachlorostannane | |
| أسماء أخرى | |
Stannic chloride | |
| المعرفات | |
| رقم CAS | 7646-78-8 10026-06-9 (خماسي الهيدرات) |
| بوب كيم (PubChem) | 24287 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | SnCl4 |
| الكتلة المولية | 260.50 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 2.23 غ/سم3 |
| نقطة الانصهار | − 34.07 °س |
| نقطة الغليان | 114.15 °س |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
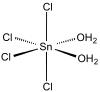
يوجد كلوريد القصدير في شكلين، الأول في الشكل اللامائي، والآخر متميه على شكل خماسي هيدرات SnCl4.5H2O، يوجد الأخير على شكل صلب أبيض.
التحضير
يحضر المركب من التفاعل المباشر بين عنصري الكلور والقصدير:
كما يمكن أن يحضر من تفاعل الكلور مع ثنائي كلوريد القصدير (كلوريد القصدير الثنائي):
الخواص
يوجد كلوريد القصدير الرباعي في درجة حرارة الغرفة على شكل سائل عديم اللون شديد الاسترطاب، وتتطاير منه الأبخرة (مدخّن) وله رائحة تشبه رائحة حمض الهيدروكلوريك.
يؤدي تماس المركب مع الماء إلى حدوث تفاعل حلمهة وتفكك المركب إلى أكسيد القصدير الرباعي (ثنائي أكسيد القصدير) وحمض الهيدروكلوريك.
يتبلور المركب عند درجة الحرارة − 33 °س وفق نظام بلوري أحادي الميل له زمرة فراغية P21/c بحيث تكون بنية الجزيئاتعلى شكل رباعيات سطوح متناظرة.[2]
توجد عدة أشكال متميهة من كلوريد القصدير الرباعي، والتي ترتكز على البنية [SnCl4(H2O)2]، والتي يمكن أن يضاف إليها جزيئات أخرى من ماء التبلور نتيجة الروابط الهيدروجينية.[3] يعد الشكل خماسي الهيدرات أشهر هذه الأشكال المتميهة، مع أنه يمكن الحصول على أشكال مائية ذات عدد أقل من الهيدرات المرتبطة.[4]
الاستخدامات
يستخدم المركب بشكل رئيسي كمركب طليعي لتحضير مركبات القصدير الأخرى؛[5] وخاصة مركبات القصدير العضوية، والتي تستخدم في مجال التحفيز ومثبتات البوليميرات.[6]
المراجع
- العنوان : Tin tetrachloride — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/24287 — تاريخ الاطلاع: 18 نوفمبر 2016 — الرخصة: محتوى حر
- Reuter, Hans؛ Pawlak, Rüdiger (أبريل 2000)، "Die Molekül- und Kristallstruktur von Zinn(IV)-chlorid"، Zeitschrift für anorganische und allgemeine Chemie (باللغة الألمانية)، 626 (4): 925–929، doi:10.1002/(SICI)1521-3749(200004)626:4<925::AID-ZAAC925>3.0.CO;2-R.
- Barnes, John C.؛ Sampson, Hazel A.؛ Weakley, Timothy J. R. (1980)، "Structures of di-μ-hydroxobis[aquatrichlorotin(IV)]-1,4-dioxane(1/3), di-μ-hydroxobis[aquatrichlorotin(IV)]-1,8-epoxy-p-menthane(1/4), di-m-hydroxobis[aquatribromotin(IV)]-1,8-epoxy-p-menthane(1/4), di-μ-hydroxobis[aquatrichlorotin(IV)], and cis-diaquatetrachlorotin(IV)"، J. Chem. Soc., Dalton Trans. (6): 949، doi:10.1039/DT9800000949.
- Genge, Anthony R. J.؛ Levason, William؛ Patel, Rina؛ Reid, Gillian؛ Webster, Michael (2004)، "Hydrates of tin tetrachloride"، Acta Crystallographica Section C، 60 (4): i47–i49، doi:10.1107/S0108270104005633.
- Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier (ردمك 0-12-352651-5)
- G. G. Graf "Tin, Tin Alloys, and Tin Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a27_049
- بوابة الكيمياء