زانثون
الزانثون هو مركب عضوي صيغته الجزيئية هي O[C6H4]2CO، ويتواجد على صورة مادة صلبة بيضاء اللون.
| زانثون | |
|---|---|
 Skeletal formula | |
 Ball-and-stick model | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
9H-Xanthen-9-one | |
| أسماء أخرى | |
9-أكسوزانثين | |
| المعرفات | |
| رقم CAS | 90-47-1 |
| بوب كيم (PubChem) | 7020 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C13H8O2 |
| كتلة مولية | 196.2 غ.مول−1 |
| المظهر | مادة صلبة بيضاء اللون |
| نقطة الانصهار | 174 °س، 447 °ك، 345 °ف |
| الذوبانية في الماء | يذوب في الماء الساخن |
| قابلية مغناطيسية | -108.1·10−6 سم3/مول |
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H301 |
| بيانات وقائية وفق GHS | P264, P270, P301+310, P321, P330, P405, P501 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
استُعمل الزانثون كمبيد حشري لأول مرة في عام 1939، ويستخدم حاليًا كمبيد للبيض للتخلص من بيض عثة التفاح، وكمبيد لليرقات.[1] كما يستخدم الزانثون في تحضير مركب الزانثيدرول، والذي يستخدم في تحديد مستويات اليوريا في الدم.[2] ويمكن استخدام الزانثون أيضًا كمحفز ضوئي.[3]
التحضير
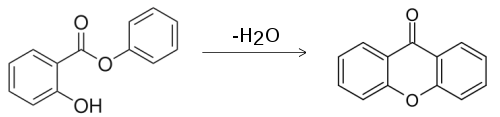
يمكن تحضير مركب الزانثون عن طريق تسخين ساليسيلات الفينيل كما هو موضح:[4]
وهناك ستة طرق مُسجّلة يُمكن من خلالها تحضير مشتقات الزانثون، وهي كما يلي:
- طريقة مايكل - كوستانيكي: والتي تستخدم خليطًا متساويًا من البولي فينول وحمض الهدروكسي بنزويك بعد أن يتم تسخينه باستخدام عامل تجفيف.
- طريقة فريدل - كرافتس: وتتضمن استخدام البنزوفينون كوسيط.
- طريقة روبنسون - نيشيكاوا: وهي نوع مختلف من تخليق هويش ولكن يتم الحصول من خلالها على مقادير منخفضة من النواتج.
- طريقة أساينا - تاناز: ويتم من خلالها تحضير بعض ميزوكسيلات الزانثونات، والزانثونات ذات المستبدلات الحساسة للأحماض.
- طريقة تاناز: وتستخدم لتخليق الزانثونات عديدة الهيدروكسي.
- طريقة أولمان: والتي تقوم بتحضير الزانثون من خلال تكثيف الفينول مع O- كلوروبنزين، ثم تحليق ثنائي الفينيل الناتج.
مشتقات الزانثون
يشكل الزانثون المكون الرئيسي لمجموعة متنوعة من المركبات والمنتجات الطبيعية مثل المانجوستين، والليكسانثون، ويشار إلى هذه المركبات أحيانًا باسم الزانثونات أو الزانثونويدات، وهناك ما يزيد عن 200 مركب زانثون طبيعي معروف لنا حتى الآن، والتي يمكن العثور عليها في العديد من المواد الكيميائية النباتية الموجودة في نباتات الفصيلة البوناتية، ونباتات الفصيلة الكلوزية، ونباتات الفصيلة البدوستمونية،[5] كما توجد أيضًا في بعض أنواع النباتات التي تنتمي إلى الفصيلة السوسنية.[6] عُثر أيضًا على بعض الزانثونات في قشرة فاكهة المانجوستين، وكذلك في لحاء وأخشاب نبات الميسوا.[7][8]
المراجع
- Steiner, L. F. and S. A. Summerland. 1943. Xanthone as an ovicide and larvicide for the codling moth. Journal of Economic Entomology 36, 435-439.
- Bowden (1962)، "The Estimation of Blood Urea by the Xanthydrol Reaction"، Journal of Small Animal Practice، 3 (4): 217–218، doi:10.1111/j.1748-5827.1962.tb04191.x.
- Romero؛ Nicewicz (10 يونيو 2016)، "Organic Photoredox Catalysis"، Chemical Reviews، 116 (17): 10075–10166، doi:10.1021/acs.chemrev.6b00057، PMID 27285582.
- A. F. Holleman (1927)، "Xanthone"، Org. Synth.، 7: 84، doi:10.15227/orgsyn.007.0084.
- "An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG II"، Botanical Journal of the Linnean Society، 141 (4): 399–436، 2003، doi:10.1046/j.1095-8339.2003.t01-1-00158.x.
- Williams؛ Harborne؛ Colasante (2000)، "The pathway of chemical evolution in bearded iris species based on flavonoid and xanthone patterns" (PDF)، Annali di Botanica، 58: 51–54، مؤرشف من الأصل (PDF) في 23 أغسطس 2016، اطلع عليه بتاريخ 28 أكتوبر 2015.
- Bandaranayake؛ Selliah؛ Sultanbawa؛ Games (1975)، "Xanthones and 4-phenylcoumarins of Mesua thwaitesii"، Phytochemistry، 14: 265–269، doi:10.1016/0031-9422(75)85052-7.
- Watterson؛ Hansen؛ Hudson؛ Alvarez-Curto؛ Raihan؛ Azevedo؛ Martin؛ Dunlop؛ Yarwood؛ Ulven, Trond؛ Milligan, Graeme (2017)، "Probe-Dependent Negative Allosteric Modulators of the Long-Chain Free Fatty Acid Receptor FFA4"، Molecular Pharmacology، 91 (6): 630–641، doi:10.1124/mol.116.107821، ISSN 0026-895X، PMC 5438128، PMID 28385906.
- بوابة علم البيئة
- بوابة الكيمياء
- بوابة صيدلة
- بوابة علم النبات