فسفورية
الفسفورية (بالإنجليزية: Phosphorescence) في الفيزياء والكيمياء هي أحد أنواع الضيائية المتعلقة بالفلورية. وعلى نقيض الفلورية، لا تصدر المادة الفسفورية مباشرة الإشعاع الذي تمتصه. فالفسفورية تصدر ضوئها الفسفوري بعد دقائق أو ساعات من امتصاصها للضوء الذي يثيرها ويختزن لفترة فيها. والفسفورية ظاهرة تبديها بعض المواد بأنها تضيء بعد تسليط الضوء عليها ثم انقطاعه، قد يستمر إصدار الضوء من المادة لعدة ساعات بعد انقطاع مصدر الضوء عنها في الظلام. وقد يكون الضوء المحفز للمادة ضوءًا مرئيًا أو أشعةً فوق بنفسجية. وقد عرف العلماء تلك الظاهرة في القرن السابع عشر 17 عن الفسفور.


تستخدم المواد الفسفورية في كثير من ألعاب الأطفال والساعات التي تضيء في الظلام. أما المواد ذات صفات فلورية، فهي تصدر ضوئها سريعا من بعد تسليط الضوء والطاقة عليها (مثل الكهرباء)، وتستخدم في مصابيح الفلورسنت.
الفسفورية والفلورية
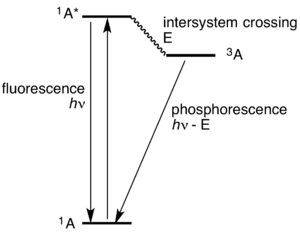
الفسفورية هي نوع من الإضاءة الباردة. وهي تختلف عن مثيلتها المسماة الظاهرة الفلورية بأن الإضاءة الفلورية تنتهي بمجرد اختفاء الضوء المحفز، وهي تختفي أثناء 1 على مليون من الثانية. أما الفسفورية فتستمر في الإشعاع بعد انطفاء مصدر الضوء المحفز، وقد تستمر الفسفورية لمدة تختلف من عدة ثوان إلى ساعات. وتبدو تلك المواد والتي تسمى مواد فسفورية كما لو أنها تخزن الضوء.
بعض المواد يظهر عليها ظاهرة الفلورية ويمكن للإلكترون المثار العودة إلى الحالة الأرضية (حالة الاستقرار) مباشرة وسريعاً (أنظر الشكل) ويصدر شعاع ضوئي له طاقة (HV). كما توجد مواد لها خاصية الفسفورية ويتم فيها انتقال الإلكترون المثار إلى مستوى طاقة وسطي في الذرة أو الجزيء (3A) يفقد خلال انتقال هذه الطاقة E ويبقى في ذلك المستوى المتوسط فترة زمنية أطول، وبعدها يعود إلى حالته الأرضية مُصدرا شعاع ضوء له الطاقة (hν - E).
تستغرق هذه الانتقالات فترة زمنية بين جزء من الثانية إلى ساعات - حسب نوع المادة - ولهذا تسمى تلك الظاهرة (الفسفورية).
الفسفور
سميت الفسفورية باسم عنصر الفسفور الذي عرفت به. ويرجع سبب إضاءة الفسفور الأبيض إلى تفاعل أكسجين الجو معه، ويعتبر هذا النوع من الضياء بالضيائية الكيميائية، وهي تعتمد على تفاعل كيميائي غير متعاكس. ويمكن صناعة مواد إضاءة فسفورية بخلطها بالفسفور.
مواد فسفورية
من المواد المستخدمة ذات الخواص الفوسفورية مادة كبريتيد الزنك وألومينات السترونشيوم. ويرجع بدء استخدام كبريتيد الزنك للاستخدامات في أدوات الأمان والوقاية من الحوادث مثل الملابس المضيئة إلى عام 1930. ثم ابتكرت ألومينات أكسيد السترونشيوم التي تتميز بشدة إضاءة تبلغ 10 أضعاف إضاءة سلفيد الزنك، ومنذ ذلك الحين استبدل ألومينات السترونشيوم عن سلفيد الزنك. وتستخدم الدهانات المحتوية على ألومينات أكسيد السترونشيوم في إضاءة مخارج الصالات العامة والسينمات، وتحديد اتجاه الطرق وملابس العاملين في بناء الطرق والشوارع وعمال المناجم. .[1][2][3]
- مقارنة بين سلفيد الزنك وألومينات السترونشيوم-
 على اليسار: كبريتيد الزنك وعلى اليمين: ألومينات السترونشيوم
على اليسار: كبريتيد الزنك وعلى اليمين: ألومينات السترونشيوم الألوان في الظلام
الألوان في الظلام الألوان في الظلام بعد مرور 4 دقائق
الألوان في الظلام بعد مرور 4 دقائق
المراجع
- RC TRITEC Super-LumiNova نسخة محفوظة 05 يوليو 2018 على موقع واي باك مشين.
- Nemoto & Co., Ltd LumiNova [وصلة مكسورة] نسخة محفوظة 09 ديسمبر 2015 على موقع واي باك مشين.
- NoctiLumina company website نسخة محفوظة 26 ديسمبر 2017 على موقع واي باك مشين.
اقرأ أيضا
- بوابة بصريات
- بوابة الكيمياء
- بوابة كيمياء فيزيائية
- بوابة الفيزياء