طاقة تنشيط
في الكيمياء والفيزياء، طاقة التنشيط[1] هي الطاقة التي يجب توفيرها لنظام كيميائي أو نووي[2] يضم مواد متفاعلة كامنة ليؤدي ذلك إلى: تفاعل كيميائي، [3]أو تفاعل نووي،[4] أو ظواهر فيزيائية أخرى مختلفة.[5][6] ويرمز لها بالرمز Ea وتستخدم وحدة كيلوجول/مول لقياسها. وقد ابتكر هذا المصطلح الكيميائي السويدي سفانت أرينيوس عام 1889م. يمكن تخفيض طاقة التفعيل من خلال استخدام حفاز (Catalyst). وطاقة التفعيل قد تكون موجبة أو سالبة.
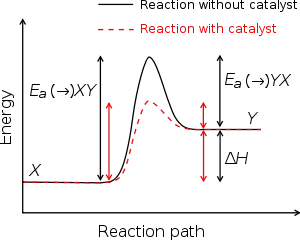
تقاس طاقة التنشيط لتفاعل (Ea) بوحدات الجول، أو كيلوجول لكل مول، أو كيلو كالوري لكل مول.[7]
يمكن اعتبار طاقة التنشيط بمثابة حجم الحاجز الكامن (الذي يُسمى أحيانًا حاجز الطاقة) والذي يفصل الحد الأدنى لسطح الطاقة الكامنة المتعلق بالحالة الثرموديناميكية الأولية والنهائية. لكي يستمر التفاعل أو الانتشار الكيميائي بمعدل معقول، يجب أن تكون درجة حرارة النظام عالية إلى الحد الكافي الذي يوجد عنده عدد ملموس من الجزيئات ذات الطاقة التحويلية التي تساوي طاقة التنشيط أو تكبرها.[8]
قُدّم مصطلح «طاقة التنشيط» في عام 1889 من قبل العالم السويدي سفانت أرينيوس.[9]
تبعية التفاعلية لدرجة الحرارة وعلاقتها بمعادلة أرينيوس
تعطي معادلة أرينيوس الأساس الكمي للعلاقة بين طاقة التنشيط والمعدل الذي يبدأ به التفاعل. من المعادلة، يمكن العثور على طاقة التنشيط من خلال العلاقة:
وفيها A هو عامل تردد التصادم للتفاعل، R هو ثابت الغاز العالمي، T هي درجة الحرارة المطلقة (مقاسة بالكلفن عادة)، وk هو معامل معدل التفاعل. حتى من دون معرفة A، يمكن حساب Ea من التباين في معاملات معدل التفاعل كدالة لدرجة الحرارة (ضمن صلاحية معادلة أرينيوس).
على مستوى أكثر تقدمًا، يمكن اعتبار المصطلح الصافي لطاقة تنشيط أرينيوس من معادلة أرينيوس على أنه معامل مُحدد تجريبيًا، ويشير إلى حساسية معدل التفاعل لدرجة الحرارة. هناك اعتراضان على ربط طاقة التنشيط هذه بالحاجز الحدي للتفاعل الأولي. أولًا، غالبًا ما يكون من غير الواضح ما إذا كان التفاعل يحدث في خطوة واحدة أم لا؛ فالحواجز الحدية التي يُحسب متوسطها في جميع الخطوات الأولية لها قيمة نظرية قليلة. ثانيًا، حتى إذا كان التفاعل المدروس أوليًا، فإن نطاقًا من الاصطدامات الفردية يساهم في ثوابت معدلات مأخوذة من تجارب كبيرة تشمل مليارات الجزيئات، مع العديد من الأشكال الهندسية والزوايا المختلفة لتفاعل الاصطدام، والطاقات الانتقالية و(ربما) الاهتزازية المختلفة، كلها قد تؤدي إلى معدلات تفاعل مجهرية مختلفة.[بحاجة لمصدر]
مصادر
- معجم المصطلحات العلمية والتقنية - مجمع القاهرة
- http://www.physics.ohio-state.edu/~kagan/phy367/Lectures/P367_lec_14.html%5Bاستشهاد+منقوص+البيانات%5D
- "Activation Energy"، www.chem.fsu.edu، مؤرشف من الأصل في 07 ديسمبر 2016، اطلع عليه بتاريخ 13 يناير 2017.
- "Lecture XIV"، www.asc.ohio-state.edu، مؤرشف من الأصل في 22 مارس 2019، اطلع عليه بتاريخ 22 مارس 2019.
- Wang, Jenqdaw؛ Raj, Rishi (1990)، "Estimate of the Activation Energies for Boundary Diffusion from Rate-Controlled Sintering of Pure Alumina, and Alumina Doped with Zirconia or Titania"، Journal of the American Ceramic Society، 73 (5): 1172، doi:10.1111/j.1151-2916.1990.tb05175.x.
- Kiraci, A؛ Yurtseven, H (2012)، "Temperature Dependence of the Raman Frequency, Damping Constant and the Activation Energy of a Soft-Optic Mode in Ferroelectric Barium Titanate"، Ferroelectrics، 432: 14، doi:10.1080/00150193.2012.707592.
- Pratt, Thomas H. "Electrostatic Ignitions of Fires and Explosions" Wiley-AIChE (July 15, 1997) Center for Chemical Process Safety[بحاجة لرقم الصفحة]
- Terracciano, Anthony C؛ De Oliveira, Samuel؛ Vazquez-Molina, Demetrius؛ Uribe-Romo, Fernando J؛ Vasu, Subith S؛ Orlovskaya, Nina (2017)، "Effect of catalytically active Ce 0.8 Gd 0.2 O 1.9 coating on the heterogeneous combustion of methane within MgO stabilized ZrO 2 porous ceramics"، Combustion and Flame، 180: 32، doi:10.1016/j.combustflame.2017.02.019.
- "Activation Energy and the Arrhenius Equation – Introductory Chemistry- 1st Canadian Edition"، opentextbc.ca (باللغة الإنجليزية)، مؤرشف من الأصل في 17 مايو 2019، اطلع عليه بتاريخ 05 أبريل 2018.
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة كيمياء فيزيائية