علم الوراثة البشري الميتوكوندري
علم الوراثة البشري الميتوكوندري هو عبارة عن دراسة وراثة الحمض النووي للميتوكوندريا البشرية. الجينوم البشري للميتوكوندريا هو مجموع المعلومات الوراثية المحتواة ضمن الميتوكوندريا البشرية. أما الميتوكوندريا فهي تراكيب صغيرة موجودة في الخلايا مهمتها تأمين الطاقة اللازمة للخلية حتى تستخدمها، وبالتالي يُشار إليها باسم «مراكز الطاقة» في الخلية.
- Mitochondria = mt
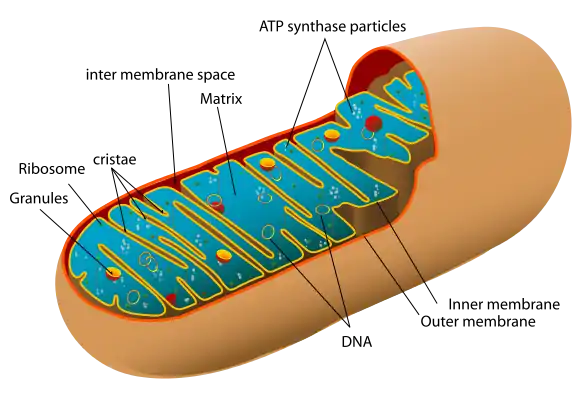
لا ينتقل الحمض النووي للميتوكوندريا (mtDNA) عبر الحمض النووي للنواة (nDNA)، وإنما ينتقل ال (mtDNA)عند البشر بشكل مُورّث فقط من بويضة الأم، مثلما يكون الحال عند معظم الكائنات المتعددة الخلايا. تقول بعض النظريات رغم ذلك أن انتقال ال (mtDNA) ممكن الحدوث من الأب في حالات وظروف معينة.[1]
لا تتوافق الوراثة في الميتوكوندريا مع القوانين الوراثية لمَندل (عالم وراثة)، إذ تفترض هذه القوانين أن نصف المادة الوراثية في البويضة الملقحة (الزيجوت) مُشتقّة من كلا الوالدين.
ثمانون في المئة من شيفرات الحمض النووي ((DNA)) هي لميتوكوندريا الحمض النووي الريبوزي ((RNA))، وبالتالي تسبب معظم الطفرات في الحمض النووي للميتوكوندريا مشاكل وظيفية، والتي يمكن أن تتمثّل باضطرابات العضلات (الاعتلالات العضلية).
تعد الميتوكوندريا ضرورية لجميع الكائنات الحية حتى تبقى على قيد الحياة وذلك لأنها توفر 38 جزيئة ATP لكل جزيء من الغلوكوز مقابل جزيئتين فقط من ال ATP تنتج عن طريق تحلل السكر. أمراض الميتوكوندريا هي اضطرابات جينية تكون محمولة ضمن الحمض النووي للميتوكوندريا. قد تكون المشاكل البسيطة في أي من الإنزيمات العديدة التي تستخدمها الميتوكوندريا مُدمّرة للخلية، وبالتالي مُدمرة للكائن الحي.
الكمية
يُشكّل الحمض النووي للميتوكوندريا (mtDNA) عند الإنسان جزيئات دائرية مغلقة تحتوي على [2][3]16,569 من الأزواج الأساسية للحمض النووي،[4] ويحتوي عادةً كل جزيء على مجموعة كاملة من جينات الميتوكوندريا، وتحتوي كل ميتوكوندريا عند الإنسان وسطيًا على حوالي 5 جزيئات من ((mtDNA، وتتراوح الكمية ما بين 1 و 15. إذ تحتوي كل خلية بشرية على ما يقارب من 100 من الميتوكوندريا، ما يجعل إجمالي عدد جزيئات ال mtDNA)) في كل خلية بشرية تقريبًا 500 جزيئة.
أنماط الوراثة
يمكن أن تنتقل أمراض الميتوكوندريا (الأمراض الناجمة عن خلل في الميتوكوندريا) وراثيًا عن طريق الأم ومن خلال وراثة الصبغيات (الكروموسومات) أيضًا، إذ تختلف الطريقة التي تنتقل بها من جيل إلى جيل آخر اختلافًا كبيرًا تبعًا للمرض. يمكن أن تحدث الطفرات الوراثية في الحمض النووي للميتوكوندريا في أي من الكروموسومات (اعتماداً على النوع). وراثة الطفرات من خلال الكروموسومات يمكن أن تكون وراثة جسدية سائدة أو مُتنحية أو تكون وراثة متعلقة بالجنس سائدة أو مُتنحية. تتبع الوراثة الكروموسومية قوانين الوراثة المندلية الطبيعية، على الرغم من حقيقة أن النمط الظاهري للمرض قد يكون مُقنّع.
يصعب تشخيص التغيرات الوراثية البسيطة بسبب الطرق المعقدة التي يتفاعل بها كل من الميتوكوندريا والحمض النووي DNA. يمكن أن تغير طفرة في الحمض النووي من بنية البروتين الذي يُنظّم (يزيد أو ينقص) إنتاج بروتين معين آخر في الميتوكوندريا أو السيتوبلازما، هذا قد يؤدي إلى أعراض طفيفة ملحوظة. من ناحية أخرى، بعض الطفرات الجينية المُدمرة التي تصيب mtDNA)) يمكن تشخيصها والكشف عنها بسهولة وذلك لأنها تُحدث تلفًا واسع النطاق في الأنسجة العضلية والعصبية والكبدية (أي الأنسجة التي تعتمد على الطاقة العالية والأيض) ولأنها موجودة عند الأم وعند النسل نفسه.
يمكن أن يختلف عدد جزيئات mtDNA المُتضررة التي ورثتها ذرية معينة اختلافًا كبيرًا بسبب:
- الميتوكوندريا داخل البويضة المُخصَّبة هي الميتوكوندريا التي يجب أن تبدأ بها الحياة الجديدة.
- يختلف عدد الميتوكوندريا المُتضررة من خلية (في هذه الحالة، البويضة المخصبة) إلى خلية أخرى اعتمادًا على العدد المُورّث من الخلية الأم وعلى العوامل البيئية التي قد تفضل الحمض النووي للميتوكوندريا من النمط الطفري أو الظاهري.
- يختلف عدد جزيئات mtDNA)) في الميتوكوندريا من حوالي اثنين إلى عشرة.
يمكن )حتى في حالات ولادة التوائم( أن يحصل أحد التوائم على أكثر من نصف جزيئات mtDNA الطافرة، بينما قد يتلقى التوأم الآخر جزءًا صغيرًا فقط من جزيئات mtDNA الطافرة فيما يتعلق بالنمط الظاهري.
توضع الجينات
يحتوي الحمض النووي للميتوكوندريا عادةً على سلسلتين من الحمض النووي مصنفة إلى سلسلة ثقيلة وخفيفة، بسبب ثخانتهما أثناء الفصل في تدرجات كلوريد السيزيوم، والذي وجد أنه مرتبط بمحتوى النكليوتيدات النسبي لـ G + T الموجود في السلسلة. ومع ذلك، فإن الالتباس في تصنيف هذه السلاسل منتشر على نطاق واسع، وظهر ذلك مع البدء بتعريف السلسلة المشفرة بالأغلبية على أنها المادة الثقيلة وذلك ضمن مقال واحد مؤثر نُشر في عام 1999. تحمل سلسلة mtDNA الخفيفة 28 جينًا بينما السلسلة الثقيلة لـ mtDNA تحمل 9 جينات فقط عن الإنسان. ثمانية من الجينات التسعة على السلسلة الثقيلة المشفرة هي تابعة لجزيئات الحمض النووي tRNA الميتوكوندرية، ويتكون mtDNA البشري من 16569 زوجًا من النوكليوتيدات. يُنظَّم الجزيء بأكمله من خلال منطقة تنظيمية واحدة فقط وهي تحوي على النسخ الأصلية المتماثلة للسلاسل الثقيلة والخفيفة، رُسم كامل جزيء الحمض النووي للميتوكوندريا البشرية بشكل تفصيلي.[5][6][7][8][9]
المتغيرات في الشيفرة الجينية
الشيفرة الجينية هي في معظمها عالمية، مع استثناءات قليلة: تشمل بعضًا من أنواع وراثة الميتوكوندريا.[10] إذ تكون كودونات التوقف (شيفرات التوقف) بالنسبة لمعظم الكائنات الحية هي: UAA و UAG و UGA. وفي الميتوكوندريا عند الفقاريات تكون: AGA و AGG هي أيضًا شيفرات توقف، ولكن ليس UGA، فهو يرمز إلى التريبتوفان بدلاً من ذلك. وترمز شيفرات AUA إلى الإيزوليوسين في معظم الكائنات الحية بينما ترمز إلى الميثيونين في mRNA عند الفقاريات.
هناك العديد من الاختلافات الأخرى بين الشيفرات المستخدمة بواسطة m/ tRNA الميتوكوندرية الأخرى، ومن حسن الحظ أنها غير ضارة بالكائنات الحية، ويمكن استخدامها كأداة (مع طفرات أخرى بين mtDNA / RNA لأنواع مختلفة) لتحديد التقارب النسبي بين الأنواع ذات الأصل المشترك، فكلما كان النوعان أكثر ارتباطًا ببعضهما، ازداد عدد الطفرات المتشابهة في جينوم الميتوكوندريا.
باستخدام هذه التقنيات قُدّر أن الميتوكوندريا الأولى نشأت منذ حوالي 1.5 مليار سنة.
النسخ المتماثلة والإصلاح والنسخ والترجمة
يجري التحكم في تكاثر الميتوكوندريا عن طريق الجينات النووية وهذه الطريقة مناسبة بشكل خاص لصنع أكبر عدد ممكن من الميتوكوندريا التي تحتاجها الخلية خلال وقت معين.
يبدأ نسخ الميتوكوندريا عند الإنسان من ثلاث جينات هي: H1 وH2 و L (سلسلة ثقيلة 1، سلسلة ثقيلة 2، وسلسلة جينية خفيفة). يقوم مُحرّض H2 بترجمة السلسلة الثقيلة بالكامل تقريبًا بينما يقوم الجين L بترجمة السلسلة الخفيفة بالكامل. يتسبب الجين H1 في نسخ جزيئين من الرنا rRNA للميتوكوندريا.[11]
بوليميراز الحمض النووي للميتوكوندريا
يستخدم بوليميراز الحمض النووي في نسخ ((mtDNA أثناء عملية النسخ المتماثل. وذلك لأن السلاسل (الثقيلة والخفيفة) على جزيء ال mtDNA الدائري لها أصول مختلفة من النسخ، فإنها تُنسخ في وضع دي- حلقة (D- Loop mode). إذ تبدأ سلسلة واحدة في النسخ المتماثل أولاً ثم تُزيح السلسلة الأخرى، وتستمر هذه العملية حتى يصل النسخ المتماثل إلى أصل النسخ في السلسلة المقابلة.
المراجع
- Schwartz, M.؛ Vissing, J. (2002)، "Paternal Inheritance of Mitochondrial DNA"، New England Journal of Medicine، 347 (8): 576–80، doi:10.1056/NEJMoa020350، PMID 12192017.
- Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG (أبريل 1981)، "Sequence and organization of the human mitochondrial genome"، Nature، 290 (5806): 457–65، doi:10.1038/290457a0، PMID 7219534.
- https://web.archive.org/web/20170917124155/http://chemistry.umeche.maine.edu/CHY431/MitoDNA.html، مؤرشف من الأصل في 17 سبتمبر 2017.
{{استشهاد ويب}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - Satoh, M.؛ Kuroiwa, T. (1991)، "Organization of multiple nucleoids and DNA molecules in mitochondria of a human cell"، Experimental Cell Research، 196 (1): 137–40، doi:10.1016/0014-4827(91)90467-9، PMID 1715276.
- Barroso Lima, Nicholas Costa؛ Prosdocimi, Francisco (27 يناير 2017)، "The heavy strand dilemma of vertebrate mitochondria on genome sequencing age: number of encoded genes or G + T content?"، Mitochondrial DNA Part A (باللغة الإنجليزية)، 29 (2): 300–302، doi:10.1080/24701394.2016.1275603، ISSN 2470-1394، PMID 28129726.
- Anderson, S.؛ Bankier, A. T.؛ Barrell, B. G.؛ de Bruijn, M. H. L.؛ Coulson, A. R.؛ Drouin, J.؛ Eperon, I. C.؛ Nierlich, D. P.؛ Roe, B. A.؛ Sanger, F.؛ Schreier, P. H.؛ Smith, A. J. H.؛ Staden, R.؛ Young, I. G. (1981)، "Sequence and organization of the human mitochondrial genome"، Nature، 290 (5806): 457–65، doi:10.1038/290457a0، PMID 7219534.
- Taanman, J. W. (09 فبراير 1999)، "The mitochondrial genome: structure, transcription, translation and replication"، Biochimica et Biophysica Acta، 1410 (2): 103–123، doi:10.1016/s0005-2728(98)00161-3، ISSN 0006-3002، PMID 10076021.
- Zimmerman, E. G.؛ Akins, D. R.؛ Planz, J. V.؛ Schurr, M. J. (سبتمبر 1988)، "A rapid procedure for isolating mitochondrial DNA"، Gene Analysis Techniques، 5 (5): 102–104، doi:10.1016/0735-0651(88)90004-0، ISSN 0735-0651، PMID 2847966.
- Welter, C.؛ Meese, E.؛ Blin, N. (1988)، "Rapid step-gradient purification of mitochondrial DNA"، Molecular Biology Reports، 13 (2): 117–120، doi:10.1007/bf00539059، ISSN 0301-4851، PMID 3221842.
- "The Genetic Codes"، www.ncbi.nlm.nih.gov، National Center for Biotechnology Information، مؤرشف من الأصل في 10 أكتوبر 2019، اطلع عليه بتاريخ 16 مارس 2019.
- Asin-Cayuela, Jordi؛ Gustafsson, Claes M. (2007)، "Mitochondrial transcription and its regulation in mammalian cells"، Trends in Biochemical Sciences، 32 (3): 111–17، doi:10.1016/j.tibs.2007.01.003، PMID 17291767.
- بوابة علم الوراثة