فلوريد البيركلوريل
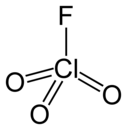
فلوريد البيركلوريل هو مركب لاعضوي من عناصر الفلور والكلور والأكسجين صيغته ClFO3، ويوجد على شكل غاز عديم اللون.[2]
| فلوريد البيركلوريل | |
|---|---|
 فلوريد البيركلوريل |
 فلوريد البيركلوريل |
| الاسم النظامي (IUPAC) | |
Perchloryl fluoride | |
| أسماء أخرى | |
Chlorine oxyfluoride, Perchlorofluoride, Chlorine fluorine oxide, Trioxychlorofluoride, Perchloric acid fluoride | |
| المعرفات | |
| CAS | 7616-94-6 |
| بوب كيم | 24258 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | ClFO3 |
| الكتلة المولية | 102.45 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 1.39 غ/سم3 |
| نقطة الانصهار | −146 °س |
| نقطة الغليان | −47 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يمكن أن يحضر المركب من إجراء تفاعل فلورة لمركب كلورات البوتاسيوم بوجود خماسي فلوريد الإثمد عند الدرجة −20 °س. كما يمكن أن تتم عملية التحضير من تفاعل بيركلورات البوتاسيوم مع حمض الفلوروكبريتيك:[3]
أو مع فلوريد الهيدروجين وخماسي فلوريد الإثمد:[4]
الخواص
يوجد المركب في الشروط القياسية على شكل غاز عديم اللون، له رائحة منفرة. يتفاعل المركب مع الكحولات ليعطي بيركلورات الألكيل، وهي مركبات حساسة تجاه الصدمة.[5]
الاستخدامات
يستخدم المركب لإضافة مجموعة الكلورات إلى المركبات العطرية وفق استبدال عطري محب للإلكترونات.[6]
طالع أيضاً
مراجع
- العنوان : Perchloryl fluoride — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/24258 — تاريخ الاطلاع: 14 أكتوبر 2016 — الرخصة: محتوى حر
- Chemical Science and Technology Laboratory، "Perchloryl fluoride"، National Institute of Standards and Technology، مؤرشف من الأصل في 04 يونيو 2020، اطلع عليه بتاريخ 28 نوفمبر 2009.
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 180.
- C. A. Wamser et al.: Perchloryl fluoride. In: Aaron Wold and John K. Ruff (Hrsg.): Inorganic Syntheses. Band 14. McGraw-Hill Book Company, Inc., 1973
- Peer Kirsch (2004)، Modern fluoroorganic chemistry: synthesis, reactivity, applications، Wiley-VCH، ص. 74، ISBN 3-527-30691-9.
- Peter Bernard David De la Mare (1976)، Electrophilic halogenation: reaction pathways involving attack by electrophilic halogens on unsaturated compounds، CUP Archive، ص. 63، ISBN 0-521-29014-7.
- بوابة الكيمياء
- بوابة رحلات فضائية
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.