قطب كلوريد الفضة
قطب كلوريد الفضة أو قطب فضة/كلوريد الفضة في الكيمياء الكهربية (بالإنجليزية: Silver Chloride electrode) هو قطب عياري يستخدم أيضا كبديل لأقطاب قياسية أخرى مثل قطب كالومل المشبع ويعتبر مثلة من النوع الثاني. القطب القياسي الذي اختاره العلماء هو قطب قياسي للهيدروجين واصطلحوا على جعله المرجع الرئيسي للأقطاب القياسية وأعطوه الجهد 000و0 فولت. بواسطة تلك الأقطاب العيارية يمكن تعيين جهد اختزال المواد، والتعرف على خصائصها الكهركيميائية.
تكوينه
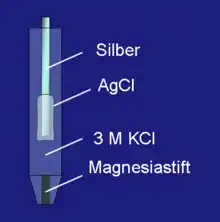

يتكون هذا القطب من سلك من الفضة مغطي بطبقة من كلوريد الفضة ومنغمسا رأسيا في محلول يحتوي على أيونات الكلور (مولية 3 M) أو في محلول مشبع من كلوريد البوتاسيوم. الرابطة الموصلة بينه وبين محلول كهرل عبارة عن سداد مسامي سفلي للقطب مصنوع من المغنسيا. تمتلئ مسام السداد بمحلول الكهرل. بذلك يجري تيار ضعيف من الأيونات يكفي لتحقيق حالة توازن لتفاعل أكسدة-اختزال على سطح القطب. يستعمل فولتمتر ذو مقاومة عالية لقياس الجهد بحيث يخفض سريان أي تيار ناشيئ.
قطب كلوريد الفضة هو أكثر الأقطاب استخداما ويستعمل في قياسات منع الصدأ في المشآت المعرضة لمياه البحر.
مبدأ عمله
يعمل قطب كلوريد الفضة كتفاعل أكسدة-اختزال حيث يجري التفاعل بين الفضة (كمعدن نقي) مع أحد أملاحه - يكون في العادة كلوريد الفضة AgCl .
تتم التفاعلات طبقا للمعادلات التالية:
أو يمكن كتابتها في معادلة واحدة كالآتي:
ويتحقق هذا التفاعل في محاليل يبلغ أسها الهيدروجيني pH بين 0 و 5و13 .
نكتب معادلة نرنست لهذا التفاعل كالآتي:
وحيث أن كلوريد الفضة قليل الذوبان في الماء فيمكن تعيين فاعلية أيونات الفضة عن طريق حساب جدوى الذوبان لكلوريد الفضة ومن فاعلية أيونات الكلور:
عندما تكون تركيز أيونات الفضة Ag+ أقل من تركيز التشبع يذوب الملح AgCl للوصول إلى حالة التشبع. وعن طريق اعتماد تركيز أيونات الفضة Ag+ عل تركيز Cl− ينشأ جهد كهربي ثابت على القطب، ويكون معتمدا فقط على تركيز أيونات الكلور.
ويمكننا الآن تبسيط الشق اللوغاريتمي في المعادلة إلى الصيغة:
طبقا لتلك المعادلة يبقى شق المعادلة الخاص بجدوى الذوبان ثابتا ويمكن كتابته مع E0 للقطب في جدول:
ونحصل على قيم مناسبة بين الجهدين E0 = 0.800 V و E'0 = 0.222 V ، و KL = 2*10−10 . ونستخدم كثيرا التركيز أو المولية بدلا عن الفاعلية activity.
تطبيقاته
تتكون الأقطاب المرجعي التجارية من أنبوب من البلاستيك يوجد به القطب. والقطب عبارة عن سلك من الفضة مطلي بطبقة رقيقة من كلوريد الفضة عن طريق إما غمس السلك في كلوريد الفضة المنصهر أو مطلي بهذا الملح بالطرق الجلفانية الكهربية بواسطة محلول مركز من حمض الهيدروكلوريك. [1]
ويسد الطرف السفلي للقطب بواسطة مغنيسا مسماية تسمح بتبادل الايونات بين قطب كلوريد الفضة وكهرل خارجي. ومن الطرف العلوي يخرج سلك من الرصاص المعزول بغرض توصيله بجهاز لقياس الجهد. ويوصل طرف فولتمتر السالب بسلك الرصاص. ويحتوي قطب كلوريد الفضة على كلوريد البوتاسيوم لموازنة تركيز كلوريد الفضة.
وبمقارنة جهد قطب كلوريد الفضة المرجعي بقطب قياسي للهيدروجين نجد أن جهده يعتمد على تركيب الكهرل:
| القطب | الجهد E0+Elj | معامل درجة الحرارة. |
|---|---|---|
| (فولت) عند 25 °C | (mV/°C) عند25 °C | |
| قطب قياسي للهيدروجين | 0.000 | 0.000 [2] |
| Ag/AgCl/Sat. KCl | +0.197 | -1.01 |
| Ag/AgCl/3.5 تركيز KCl[3] | +0.205 | -0.73 |
| Ag/AgCl/3.0 تركيز KCl | +0.210 | ? |
| Ag/AgCl/1.0 تركيز KCl | +0.235 | +0.25 |
| Ag/AgCl/0.6 تركيز KCl | +0.25 | |
| Ag/AgCl (ماء البحر) | +0.266 |
ملاحظات على الجدول:
(1) مصدر الجدول [4] ما عدا ما ذكر من مصدر مخالف.
(2) Elj هو جهد الوصلة السائلة بين الكهرل المراد قياسه والكهرل المحتوي على الكلوريد ذو فاعلية 1 مول/كيلوجرام.
ويتميز قطب كلوريد الفضة بعدة صفات تجعله مناسبا للاستعمال في حقول عديدة:
- سهل التكوين
- معتدل التكاليف
- جهد مستقر
- لا يحتوي على مواد ضارة.
يجهز قطب كلوريد الفضة بكهرل يحتوي على محلول مشبع لكلوريد البوتاسيوم، ولكن يمكن استخدامه أيضا ب تركيز أقل، مثل 1 مول/كيلوجرام من كلوريد البوتاسيوم.
وكما ذكرنا أعلاه يتغير جهد القطب بتغير اركيز الكهرل. يذوب كلوريد الفضة طفيفا في محلول مركز من كلوريد البوتاسيوم، ولهذا يُفضل أن يُشبع كلوريد البوتاسيوم بكلوريد الفضة لمنع فقدان كلوريد الفضة من على سلك الفضة.
استخدامه عند درجات حرارة عالية
عندما يكون قطب كلوريد الفضة مصنوعا جيدا يمكن استخدامه حتى درجة 300 درجة مئوية. ويعتمد الجهد القياسي له (أي عندما تكون فاعلية الكلوريد 1 مول/كيلوجرام) على درجة الحرارة كالآتي:
| درجة الحرارة | الجهد E0 |
|---|---|
| °C | فولت بالمقارنة بقطب قياسي للهيدروجين عند نفس درجة الحرارة |
| 25 | 0.22233 |
| 60 | 0.1968 |
| 125 | 0.1330 |
| 150 | 0.1032 |
| 175 | 0.0708 |
| 200 | 0.0348 |
| 225 | -0.0051 |
| 250 | -0.054 |
| 275 | -0.090 |
يعطي العالم «بارد» وزملاؤه [6] العلاقة التالية لاعتماد الجهد المرجعي لقطب كلوريد الفضة على درجة الحرارة (حيث t درجة الحرارة المئوية):
E0(V) = 0.23695 - 4.8564x10−4t - 3.4205x10−6t2 - 5.869 x 10−9t3 for 0 <t <95 °C.
كما يذكر «بارد» في نفس المرجع معادلة مناسبة تصف تغير الجهد بتغير درجة الحرارة عند درجات الحرارة العالية، وهي تعطي البيانات المذكورة في القائمة:
E0(V) = 0.23735 - 5.3783x10−4t - 2.3728x10−6t2 for 25 <t <275 °C.
عند استنباط القيمة عند 300 درجة مئوية يحصل على E0 = -0.138 V.
- كما يعطي العالم «جوزيف فارمر» [7]
العلاقة التالية لاعتماد جهد قطب كلوريد فضة ذو تركيز 1و0 مول/كيلوجرام لمحلول كلوريد البوتاسيوم والذي تعتمد عليه فاعلية أيونات الكلور Cl- في درجات الحرارة العالية، كالآتي:
E0.1 mol/kg KCl(V) = 0.23735 - 5.3783x10−4t - 2.3728x10−6t2 - 2.2671x10−4(t+273) for 25 <t <275 °C.
تحويل جهد قطب كلوريد الفضة إلى قطب آخر
يوجد جدول يبين معاملات تحويل جهد قطب كلوريد الفضة لاستنباط جهد قطب عياري آخر، والعكس (انظر جهد اختزال).
اقرأ أيضا
المراجع
- Detail of Making and Setting up a Microelectrode, University of Denver, http://carbon.cudenver.edu/~bstith/detailelectrode.doc (link is obsolete) نسخة محفوظة 11 أكتوبر 2006 على موقع واي باك مشين.
- Bratsch, Steven G. (1989)، "Standard Electrode Potentials and Temperature Coefficients in Water at 298.15 K" (PDF)، J. Phys. Chem. Ref. Data، ج. 18، ص. 1–21، doi:10.1063/1.555839، مؤرشف من الأصل (PDF) في 29 يونيو 2011
- D.T. Sawyer, A. Sobkowiak, J.L. Roberts, "Electrochemistry for Chemists", 2nd edition, J. Wiley and Sons Inc., 1995.
- "NACE International CP Specialist Course Manual" نسخة محفوظة 20 سبتمبر 2012 على موقع واي باك مشين.
- R.S. Greeley, J. Phys. Chemistry, 64, 652, 1960.
- A.J. Bard, R. Parson, J. Jordan, "Standard Potentials in Aqueous Solution", Marcel Dekker, Inc., 1985.
- Joseph Farmer, "Waste Package Degradation Expert Elicitation Panel: Input on the Corrosion of CRM Alloy C-22", Lawrence Livermore National Laboratory, report UCRL-ID-130064 Information Bridge: DOE Scientific and Technical Information - Sponsored by OSTI (pdf) نسخة محفوظة 11 مايو 2020 على موقع واي باك مشين.
- بوابة كهرباء
- بوابة الكيمياء