قياس التأكسج النبضي
قياس التأكسج النبضي[1] (بالإنجليزية: Pulse oximetry) هي تقنية تستخدم لمعرفة نسبة تأكسد الدم بطريقة غير مباشرة (كون الطريقة المباشرة هي أخذ عينة من الدم الشرياني وتحليلها) كما يقيس الجهاز عدد نبضات القلب. وعلى الرغم من أن قراءة الجهاز لتأكسد الدم (تشبع الدم المحيطي بالأكسجين SpO2) ليست دائما مطابقة لقراءة تشبع الأكسجين الشرياني SaO2 من تحليل غازات الدم الشرياني، ألا أنها طريقة آمنة، ومريحة، وليست جائرة أو مكلفة لقياس تشبع الدم بالأكسجين في الاستخدام السريري. وأول جهاز تم اختراعه كان عام 1940 بواسطة ميليكن (Milliken).
| قياس التأكسج النبضي | |
|---|---|
 | |
| إي ميديسين | |

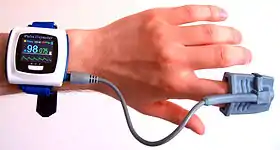
يتم وضع جهاز استشعار على جزء رقيق من جسم المريض، عادة حول أحد أصابع اليد أو شحمة الأذن، أو حول القدم في حالة الرضيع. ويمرر الجهاز موجتين من الضوء خلال الجسم إلى مستقبل ضوئي. ويقيس الجهاز الامتصاصية المتغيرة عند كل طول موجي، مما يسمح له بتحديد الامتصاصية عن طريق نبض الدم الشرياني وحده، واستثناء الدم الوريدي، والجلد، والعظام، والعضلات، والدهون، وطلاء الأظافر (في معظم الحالات).[2]
وبصورة أقل شيوعا، يُستخدم قياس التأكسج بالانعكاس كبديل لقياس التأكسج الموصوف أعلاه. ولا تتطلب هذه الطريقة جزء رقيق من جسم الشخص، وبالتالي فهي مناسبة تماما للتطبيق على أي جزء مثل القدمين، والجبين، والصدر، ولكن لديها أيضا بعض القيود. حيث يمكن أن يُسبب توسع الأوعية الدموية وتجمع الدم الوريدي في الرأس بسبب العائد الوريدي إلى القلب واختلاط النبض الشرياني مع الوريدي في منطقة الجبين مما يؤدي إلى نتائج خاطئة. وتحدث مثل هذه الظروف مع مرضى أمراض القلب الخلقية، أو في المرضى في وضعية ترندلينبورغ.[3]
تاريخ
في عام 1935، اخترع كارل ماثيس (طبيب ألماني 1905-1962) أول مقياس تشبع للأكسجين باستخدام الطول الموجي للأشعة مع مرشحات حمراء وخضراء (تحولت لاحقا إلى مرشحات حمراء وأشعة تحت الحمراء). وكان مقياسه أول جهاز لقياس التشبع بالأكسجين.[4]
وكان قد قُدِّم مقياس التأكسج الأصلي من قِبَل جلين ألان ميليكين في أربعينات القرن التاسع عشر.[5] وفي عام 1949 أضاف وود كبسولة الضغط لضغط الدم خارج الأذن وذلك للحصول على القيمة المطلقة للتشبع بالأكسجين عند عودة الدم. وذلك المفهوم مشابه لمقياس التأكسج التقليدي اليوم، ولكنه كان صعب التنفيذ بسبب الخلايا الضوئية غير المستقرة ومصادر الضوء، ولا يتم استخدام هذه الطريقة الآن عمليًا. في عام 1964 ركّب شو أول مقياس للتأكسج بالأذن وجمع القراءة باستخدام ثمانية موجات من الضوء. وتم تسويقه من قِبَل شركة هيوليت-باكارد، ولكن استخدامه كان يقتصر على وظائف الرئة ومختبرات النوم بسبب التكلفة والحجم.
اخترع تاكوو أوياجي، وميشيو كيشي، وبعض المهندسين البيولوجيين جهاز قياس التأكسج في عام 1972، في نيهون كوهدن باستخدام نسبة امتصاص المكونات النابضة في مكان القياس للأشعة الحمراء إلى الأشعة تحت الحمراء. وقام الجراح سوسومو ناكاجيما وشركاؤه باختبار الجهاز لأول مرة على المرضى في عام 1975.[6] وتم تسويقه من قِبَل شركة بيوكس في عام 1981، وشركة نلكور في عام 1983. تأسست شركة بيوكس في عام 1979، وقدمت أول مقياس للتأكسج للتوزيع التجاري في عام 1981. ركزت شركة بيوكس في البداية على العناية بالجهاز التنفسي، ولكن عندما اكتشفت الشركة أن مقاييس التأكسج كانت تستخدم في غرف العمليات لمراقبة مستويات الأكسجين، وَسّعَت بيوكس مواردها التسويقية للتركيز على غرف العمليات في أواخر عام 1982. بدأت شركة نلكور (الآن جزء من شركة كوفيديان) للتنافس مع بيوكس على سوق غرف العمليات في الولايات المتحدة في عام 1983. وقبل معرفة مقياس التأكسج، كان لا يمكن قياس تأكسد دم المريض إلا بواسطة تحليل غازات الدم الشرياني، والذي كان يستغرق عدة دقائق لجمع العينات ومعالجتها من قِبَل المختبر. في غياب الأكسجين، يبدأ تلف الدماغ في غضون 5 دقائق يليه وفاة الدماغ في غضون 10-15 دقيقة أخرى. وتتجاوز السوق العالمية لقياس التأكسج النبضي مليار دولار. ومع إدخال قياس التأكسج النبضي، أصبح من الممكن قياس الأكسجة بشكل مستمر وغير جائر للمريض، مما أحدث ثورة في ممارسة التخدير وتحسنًا كبيرًا في توفير الأمان والسلامة للمرضى. قبل ظهوره، قدرت بعض الدراسات في صحف التخدير أن وفيات المرضى في الولايات المتحدة نتيجة لنقص الأكسجة غير المكتشفة من 2000 إلى 10,000 حالة وفاة سنويًا، مع عدم وجود تقدير معروف لمراضة المرضى.
وبحلول عام 1987، كان معيار الرعاية لإعطاء مخدر عام في الولايات المتحدة يتضمن قياس التأكسج. ومن غرفة العمليات، انتشر استخدام قياس التأكسج بسرعة في جميع أنحاء المستشفى، أولا إلى غرفة الإفاقة، ومن ثَم إلى وحدات العناية المركزة المختلفة. وكان قياس التأكسج ذو قيمة خاصة في وحدة حديثي الولادة حيث لا ينمو المرضى إذا كان الأكسجين غير كافٍ، ولكن الكثير من الأكسجين والتقلبات في تركيز الأكسجين يمكن أن يؤدي إلى ضعف البصر أو العمى نتيجة اعتلال الشبكية عند الأطفال الخدج. وعلاوة على ذلك، فإن الحصول على غازات الدم الشرياني من مريض حديث الولادة مؤلم للمريض وهو سبب رئيسي لفقر الدم الوليدي.[7] ويمكن أن تكون الحركة الصناعية قيدا كبيرا لرصد قياس التأكسج مما يؤدى إلى الإنذارات الكاذبة المتكررة وفقدان البيانات. والسبب في ذلك هو أنه أثناء الحركة وانخفاض الإشباع الطرفي، كثير من مقاييس التأكسج لا يمكنها التمييز بين نبض الدم الشرياني ونقل الدم الوريدي، مما يؤدي إلى تقليل القيمة المقدَرَة من تشبع الأكسجين. وأظهرت الدراسات المبكرة لأداء قياس التأكسج أثناء حركة الشخص نقاط الضعف لتقنيات قياس التأكسج النبضي التقليدية للحركة الصناعية.[8][9] في عام 1995، قدم ماسيمو تقنية استخراج الإشارات التي يمكنها القياس بدقة أثناء حركة المريض وانخفاض التروية عن طريق فصل إشارة الشرايين من الإشارات الوريدية وغيرها. ومنذ ذلك الحين، طور مُصّنعو قياس التأكسج النبضي خوارزميات جديدة لتقليل بعض الإنذارات الكاذبة أثناء الحركة[10] مثل امتداد متوسط المرات أو قيم التجميد على الشاشة، لكنهم لا يدعون لقياس الظروف المتغيرة أثناء الحركة ونضح التروية. لذلك، لا تزال هناك اختلافات هامة في أداء مقاييس التأكسج خلال الظروف الصعبة.[11]
في عام 2004، وجدت هيئة محلفين أن شركة نلكور تنتهك العديد من براءات اختراع ماسيمو المتعلقة بتقنية معالجة إشارة القياس خلال الحركة وانخفاض التروية. وفي عام 2005، أكدت محكمة الاستئناف نتائج التعدي على نلكور وأصدرت تعليمات إلى المحكمة المحلية بإصدار أمر قضائي دائم ضد مقاييس التأكسج الخاصة بنلكور (مثل N-395، N-595) التي تَبَيَن أنها مخالِفة. وفي يناير 2006، أبرم ماسيمو ونلكور اتفاق تسوية، حيث وافقت شركة نلكور، على وقف شحن مقاييس التأكسج التي تبين أنها تنتهك براءات اختراع ماسيمو.
وقد قارنت الأوراق المنشورة تكنولوجيا استخراج الإشارات بتقنيات قياس التأكسج الأخرى. وأظهرت نتائج مواتية لتكنولوجيا استخراج الإشارات.[12][13][14] وقد تبين أيضا أن تقنية قياس إشارة مقياس التأكسج تُتَرجَم إلى مساعدة الأطباء على تحسين نتائج المرضى. في إحدى الدراسات، تم تقليل اعتلال الشبكية عند الأطفال الخدج (تلف العين) بنسبة 58% في حديثي الولادة منخفضي الوزن في مركز يستخدام تقنية استخراج إشارة، في حين لم يكن هناك انخفاض في اعتلال الشبكية من الخداج في مركز آخر مع نفس الأطباء باستخدام نفس البروتوكول ولكن مع عدم استخدام تكنولوجيا استخراج الإشارة.[15] وقد أظهرت دراسات أخرى أن قياس التأكسج باستخدام تكنولوجيا استخراج الإشارة أدى إلى عدد أقل من قياسات غازات الدم الشرياني، وانخفاض استخدام الاستشعار، وانخفاض مدة البقاء في المستشفى.[16] وتسمح قابلية القياس خلال الحركة والتروية المنخفضة أيضا باستخدامها في المناطق التي لم يسبق لها الرصد سابقا. وكدليل على ذلك، تم نشر دراسة تاريخية في عام 2010 أظهرت أن الأطباء الذين يستخدمون تكنولوجيا استخراج الإشارات لقياس التأكسج في الطابق العام كانوا قادرين على تقليل تفعيل فريق الاستجابة السريعة، وتقليل نقل وحدة العناية المركزة، وتقليل أيام وحدة العناية المركزة.[17]
في عام 2011، أوصت مجموعة عمل مكونة من بعض الخبراء بفحص حديثي الولادة بقياس التأكسج النبضي لزيادة الكشف عن أمراض القلب الخلقية الحرجة.[18] وقد أشارت مجموعة العمل إلى نتائج دراستين استباقيتين كبيرتين على 59,876 شخصًا تستخدمان تكنولوجيا استخراج الإشارات بشكل حصري لزيادة تحديد أمراض القلب الخلقية مع الحد الأدنى من النتائج الإيجابية الخاطئة.[19][20] كما أوصت مجموعة العمل بفحص حديثي الولادة بمقياس التأكسج مع الحركة الذي تم التحقق من صحته أيضًا في حالات التروية المنخفضة. وفي عام 2011، أضاف وزير الصحة والخدمات الإنسانية في الولايات المتحدة مقياس التأكسج إلى لوحة الفحص الموحدة الموصى بها.[21] قبل الأدلة على الفحص باستخدام تقنية استخراج الإشارات، تم فحص أقل من 1% من الأطفال حديثي الولادة في الولايات المتحدة. اليوم، وقد وثقت مؤسسة حديثي الولادة الفحص الشامل في الولايات المتحدة، كما يتسع الفحص الدولي بسرعة.[22] في عام 2014، أظهرت دراسة كبيرة ثالثة على 122.738 من حديثي الولادة والتي تستخدم حصرا تكنولوجيا استخراج الإشارة نتائج مماثلة إيجابية كما الحال مع الدراستين الكبيرتين الأولتين.[23]
وقد تم تطوير مقياس تأكسج عال الدقة لفحص توقف التنفس أثناء النوم في المنزل واختبار المرضى الذين لا يمكن فحصهم عمليا ب تخطيط النوم.[24][25][26] إنه يخزن ويسجل كل من معدل النبض وتشبع الدم المحيطي بالأكسجين على فترات تفصلها ثانية واحدة، وقد تبين في دراسة ما أن ذلك يساعد في الكشف عن اختلال التنفس أثناء النوم في المرضى الجراحيين.[27]
في عام 1995 قدم ماسيمو مؤشر تروية يحدد سعة الموجة المكونَة بمخطاط التحجم الطرفي. وقد تبين أن مؤشر الإرواء يساعد الأطباء على توقع شدة المرض والنتائج التنفسية السلبية في وقت مبكر في حديثي الولادة،[28][29][30] والتنبؤ بانخفاض تدفق الوريد الأجوف العلوي في الرضع الذين يكون وزنهم عند الولادة منخفض جدا،[31] وتوفير مؤشر مبكر لقطع الجهاز العصبي الودي بعد تخدير فوق الجافية،[32] وتحسين الكشف عن أمراض القلب الخلقية الحرجة في حديثي الولادة.[33]
في عام 2007، قدم ماسيمو أول قياس لمؤشر التباين، الذي أظهرت دراسات سريرية متعددة أنه يوفر طريقة جديدة للتقييم التلقائي غير الجائر لقدرة المريض على الاستجابة للسوائل التي تُعطى له.[34][35][36] تعتبر مستويات السوائل المناسبة أمرا حيويا للحد من مخاطر ما بعد الجراحة وتحسين نتائج المرضى، فقد تبين أن أحجام السوائل المنخفضة جدا أو العالية جدا تقلل من التئام الجروح، وتزيد من خطر العدوى أو المضاعفات القلبية.[37] وفي الآونة الأخيرة، أدرج قسم الصحة الوطنية في المملكة المتحدة وجمعية التخدير والرعاية الحرجة الفرنسية رصد مؤشر التباين كجزء من إستراتيجياتها المقترحة لاستخدام السوائل داخل العمليات.[38][39]
طريقة عمل الجهاز
يُسمى الجهاز مقياس التأكسج النبضي (بالإنجليزية: pulse oximeter)، ويوضع الجهاز عادة حول أحد أصابع اليد. و من أحد الجوانب يبث الجهاز إضاءة حمراء و أشعة تحت الحمراء و يوجد في الجانب الآخر مستقبل ضوئي. يقيس هذا المستقبل كمية الضوء الممتص. ومن المعروف أن الخواص الفيزيائية للهيموجلوبين المتأكسد تختلف عن تلك الغير المتأكسد بحيث أن الهيموجلوبين المتأكسد يمتص الأشعة تحت الحمراء أكثر من غير المتأكسد. بينما الهيموجلوبين غير المتأكسد يمتص الضوء الأحمر أكثر ويسمح للأشعة تحت الحمراء بالنفاذ.[40] هكذا يقوم الجهاز بقياس كمية الضوء الأحمر والأشعة تحت الحمراء ويحلل كمية الأكسجين في الدم. و تعتبر هذه الأجهزة دقيقة حيث أن نسبة الخطأ -إذا كانت نسبة التأكسج 70-100% في الدم- تساوي ±2%.[41]
الوظيفة

يعرض رصد الأكسجين في الدم نسبة الدم التي يتم تحميلها بالأكسجين. وبشكل أكثر تحديدا، فإنه يقيس النسبة المئوية من الهيموجلوبين (بروتين في الدم يحمل الأكسجين) الذي يُحمَّل بالأكسجين. النطاقات الطبيعية المقبولة للمرضى الذين لا يعانون من أمراض رئوية هي من 95 إلى 99 في المئة. بالنسبة للمريض الذي يتنفس هواء الغرفة عند أو بالقرب من سطح البحر، يمكن إجراء تقدير الأكسجين في الدم الشرياني برصد قراءة تشبع الأكسجين الطرفي.
يستخدم مقياس التأكسج النموذجي معالجًا إلكترونيًا وزوج من الصمامات الثنائية الصغيرة الباعثة للضوء التي تواجه ثنائي ضوئي من خلال جزء شفاف من جسم المريض، وعادة ما يكون الإصبع أو شحمة الأذن. أحد الثنائيات الباعثة للضوء أحمر، بطول موجي 660 نانومتر، والآخر هو الأشعة تحت الحمراء مع بطول موجي 940 نانومتر. يختلف امتصاص الضوء عند هذه الأطوال الموجية اختلافا كبيرا بين الدم المحمل بالأكسجين والدم المفتقر للأكسجين. يمتص الهيموجلوبين المؤكسج المزيد من ضوء الأشعة تحت الحمراء ويسمح للكثير من الضوء الأحمر بالمرور من خلاله. بينما يسمح الهيموجلوبين الغير مؤكسج بمرور ضوء الأشعة تحت الحمراء من خلاله، ويمتص الضوء الأحمر. ويتم قياس مقدار الضوء الذي ينقل (بمعنى آخر، الذي لا يمتص)، وتنتج إشارات معيارية منفصلة لكل طول موجة. تتذبذب هذه الإشارات في وقت ما لأن كمية الدم الشرياني الموجود تزيد (تنبض حرفيا) مع كل نبضة للقلب. وعن طريق طرح الضوء الأدنى المنقول من ذروة الضوء المرسل في كل طول موجة، يتم تصحيح تأثير الأنسجة الأخرى.[42] ثم يتم حساب نسبة الضوء الأحمر المقاسة إلى ضوء الأشعة تحت الحمراء المقاس من قِبَل المعالج (والذي يمثل نسبة الهيموغلوبين المؤكسج إلى الهيموجلوبين غير المؤكسج)، ثم يتم تحويل هذه النسبة إلى مقدار التشبع الطرفي بالأكسجين من قِبَل المعالج عن طريق مصفوفة[42] على أساس قانون بير لامبرت.[43]
دواعي الاستعمال

مقياس التأكسج النبضي هو جهاز طبي يرصد بشكل غير مباشر تشبع الأكسجين بدم المريض (بدلا من قياس تشبع الأكسجين مباشرة من خلال عينة الدم) والتغيرات في حجم الدم في الجلد، منتجا مخطاط التحجم الضوئي. ويمكن تضمين مقياس التأكسج النبضي في جهاز مراقبة المريض متعدد الأقطاب. كما تعرض معظم أجهزة المراقبة معدل النبض. كما تتوفر أجهزة قياس التأكسج المحمولة التي تعمل بالبطارية للتنقل أو مراقبة الأكسجين في الدم في المنزل.
مميزاته
يمتاز الجهاز بسهولة تشغيله ورخص ثمنه، أنه وسيلة غير جائرة لقياس تشبع الأكسجين، على عكس تحليل غازات الدم التي تتطلب تحليل عينة الدم المسحوبة في المختبر. وبسبب بساطتها في الاستخدام والقدرة على توفير قيم تشبع الأكسجين المستمر والفوري، نجده متوفر في أي مكان يكون فيه أكسجين المريض غير مستقر بما في ذلك أغلب أجنحة المستشفى، وغرف العمليات، والطوارئ، والعناية المركزة. إن مقياس التأكسج ذو أهمية حساسة في طب الطوارئ وهو أيضًا مفيد جدًا للمرضى الذين يعانون من مشاكل في الجهاز التنفسي أو القلب، وخاصة مرض الانسداد الرئوي المزمن، أو لتشخيص بعض اضطرابات النوم مثل انقطاع النفس وضعف التنفس.[44] وتعتبر أجهزة قياس التأكسج المحمولة التي تعمل بالبطارية مفيدة للطيارين العاملين في طائرة غير مضغوطة فوق 10,000 قدم (12,500 قدم في الولايات المتحدة)[45] حيث يلزم الأكسجين التكميلي. كما أن مقاييس التأكسج المحمولة مفيدة أيضا لمتسلقي الجبال والرياضيين الذين قد تنخفض مستويات الأكسجين لديهم على ارتفاعات عالية أو بممارسة التمارين الرياضية. تستخدم بعض مقاييس التأكسج المحمولة برمجيات تختبر الأكسجين في الدم ونبض الدم، وتكون بمثابة تذكير للتحقق من مستويات الأكسجين في الدم.
ولأهميته، يُتَوقع بأن تزداد مبيعات هذا الجهاز في الولايات المتحدة الأمريكية بأكثر من 150% خلال الست سنوات القادمة. وأن ترتفع قيمة مبيعات الجهاز من 201$ عام 2006 إلى 310$ عام 2013 في الولايات المتحدة الأمريكية فقط.[46]
على الرغم من أن مقياس التأكسج النبضي يستخدم لرصد أكسجة الدم، فإنه لا يمكنه تحديد عملية الأيض للأكسجين، أو كمية الأكسجين التي يستهلكها المريض. ولهذا الغرض، من الضروري أيضًا قياس مستويات ثاني أكسيد الكربون. ومن الممكن أن يستخدم أيضًا للكشف عن الاضطرابات في التهوية. ومع ذلك، فإن استخدام مقياس التأكسج النبضي لا يمكنه الكشف عن نقص التهوية في حالة استخدام الأكسجين التكميلي، حيث أنه يُستخدم فقط للكشف عن حدوث اضطرابات في وظيفة الجهاز التنفسي عندما يكون الشخص يتنفس هواء الغرفة. ولذلك، فإن الإعطاء الروتيني للأكسجين التكميلي قد يكون غير مبرر إذا كان المريض قادرا على الحصول على الأكسجين الكافي من هواء الغرفة، لأنه يمكن أن يؤدي إلى نقص التهوية غير المكتشفة.[47]
ملاحظات
يقيس مقياس التأكسج تشبع الهيموغلوبين فقط، وليس التهوية ولا يعتبر مقياسا كاملا لكفاءة الجهاز التنفسي. وليس بديلا عن فحص غازات الدم في المختبر، لأنه لا يعطي أي مؤشر على العجز الأساسي، أو مستويات ثاني أكسيد الكربون، أو درجة الحموضة في الدم، أو تركيز البيكربونات. ويمكن قياس عملية التمثيل الغذائي للأكسجين بسهولة عن طريق رصد ثاني أكسيد الكربون في هواء الزفير، ولكن أرقام التشبع لا تعطي أي معلومات عن محتوى الأكسجين في الدم. معظم الأكسجين في الدم مُحمَل على الهيموجلوبين. وفي حالة فقر الدم الشديد، يحمل الدم أكسجين كلي أقل، على الرغم من أن الهيموغلوبين مشبع بنسبة 100٪.
قد تكون القراءات منخفضة بشكل غير طبيعي بسبب نقص التروية في الطرف المستخدم للرصد (غالبا ما يكون بسبب برودته، أو بسبب تضيق الأوعية الدموية الثانوي لاستخدام المواد الرافعة للضغط). ولضمان الدقة، يجب على جهاز الاستشعار أن يرسل نبضة و/أو شكل موجة نبضية ثابتة. وتختلف تقنيات قياس التأكسج في قدراتها على توفير بيانات دقيقة خلال ظروف الحركة والنضح المنخفض.[13][48]
قياس التأكسج أيضًا ليس مقياسا كاملا لكفاءة الدورة الدموية. إذا كان هناك تدفق دم غير كاف أو كان الهيموغلوبين في الدم غير كاف (فقر الدم)، قد تعاني الأنسجة من نقص الأكسجة على الرغم من ارتفاع تشبع الأكسجين في الدم. وفي عام 2008، قدم ماسيمو مقياسا للتأكسج يمكنه قياس مستويات الهيموجلوبين بالإضافة إلى تشبع الأكسجين. ولتحديد كمية الهيموجلوبين، يستخدم الجهاز أطوال موجية إضافية من الضوء غير الموجتين القياسيتين.
وبما أن قياس التأكسج النبضي يقيس فقط نسبة الهيموجلوبين المربوطة، فقد تنتج قراءة عالية زائفة أو منخفضة زائفة عندما يرتبط الهيموجلوبين بشيء آخر غير الأكسجين:
- الهيموجلوبين لديه انجذاب أعلى لأول أكسيد الكربون من الأكسجين، وقد تنتج قراءة عالية على الرغم من أن المريض في الواقع يعاني من نقص الأكسجين. وفي حالات التسمم بأول أكسيد الكربون، قد تؤدي عدم الدقة هذه إلى تأخير التعرف على نقص الأكسجين (انخفاض مستوى الأكسجين الخلوي).
- يعطي التسمم بالسيانيد قراءة عالية، لأنه يقلل من استخراج الأكسجين من الدم الشرياني. في هذه الحالة، القراءة ليست كاذبة، لأن الأكسجين في الدم الشرياني يكون عاليًا في الواقع في وقت مبكر عند التسمم بالسيانيد.
- يسبب ميثيموغلوبين الدم بشكل خاص قراءات قياس التأكسج النبضي في منتصف 80s.
- قد يسبب مرض الانسداد الرئوي المزمن [التهاب الشعب الهوائية المزمن بشكل خاص] قراءات خاطئة.[49]
وهناك طريقة غير جائرة تسمح بالقياس المستمر للهيموجلوبين المحمل والغير محمل بالأكسجين والهيموجلوبين المحمل بمواد أخرى غير الأكسجين، وذلك باستخدام مقياس أول أكسيد الكربون، الذي تم اختراعه في عام 2005 من قِبَل ماسيمو. ويوفر للأطباء وسيلة لقياس الكربوكسي هيموغلوبين، والميتيموغلوبين جنبا إلى جنب مع الهيموغلوبين الكلي.
لذا نجد أن الجهاز لايستطيع تقدير كمية التأكسد في الحالات التالية:
- قصور في التروية الدموية في مكان القياس.
- الإضاءات القوية كما في غرف العمليات قد تؤثر على أداء الجهاز.
- لا يستطيع الجهاز التفريق بين الهيموجلوبين المتأكسد والميتهيموجلوبين.
- طلاء الأظافر قد يمنع مرور الضوء وبالتالي يعطي الجهاز قراءة خاطئة.
زيادة الاستخدام
وفقا لتقرير أعده بحث أي داتا، فإن سوق رصد قياس التأكسج في الولايات المتحدة للمعدات وأجهزة الاستشعار كان يزيد عن 700 مليون دولار أمريكي في عام 2011.[50] وفي عام 2008، كان أكثر من نصف الشركات المصنعة الرئيسية للمعدات الطبية المصدِرة دوليا في الصين منتجين لمقاييس التأكسج.[51]
وفي يونيو 2009، أعلنت شركة ألعاب الفيديو نينتندو عن الملحق القادم لريموت وي، يطلق عليه اسم "استشعار الحيوية"، والذي يتكون من مقياس التأكسج النبضي. وهذا يمثل بداية استخدام هذا الجهاز لأغراض ترفيهية غير طبية.[52][53]
تستخدم ساعة أبل هذه التقنية لمراقبة معدل ضربات القلب.[54][55] وقد تم مناقشة دقة رصد معدل ضربات القلب، ولكن أظهرت اختبارات مختلفة أنها تكون دقيقة جدا.[56]
مؤشر التباين
مؤشر التباين هو مقياس لتباين سعة موجات المخطاط الحجمي.[57] و يعطي التباين الأكثر من 14% فرصة أكبر للاستجابة لموسعات الحجم.[57]
انظر أيضًا
المراجع
- "Al-Qamoos القاموس - English Arabic dictionary / قاموس إنجليزي عربي"، www.alqamoos.org، مؤرشف من الأصل في 07 مارس 2020، اطلع عليه بتاريخ 7 مارس 2020.
- Brand TM, Brand ME, Jay GD (فبراير 2002)، "Enamel nail polish does not interfere with pulse oximetry among normoxic volunteers"، J Clin Monit Comput، 17 (2): 93–6، doi:10.1023/A:1016385222568، PMID 12212998.
- Jorgensen JS, Schmid ER, Konig V, Faisst K, Huch A, Huch R (1995)، "Limitations of forehead pulse oximetry"، J Clin Monit، 11 (4): 253–256، doi:10.1007/bf01617520.
- Matthes, K (1935)، "Untersuchungen über die Sauerstoffsättigung des menschlichen Arterienblutes" [Studies on the Oxygen Saturation of Arterial Human Blood]، Naunyn-Schmiedeberg's Archives of Pharmacology (باللغة الألمانية)، 179 (6): 698–711، doi:10.1007/BF01862691، مؤرشف من الأصل في 7 مارس 2020، اطلع عليه بتاريخ 28 أبريل 2011.
- Millikan G. A. (1942)، "The oximeter: an instrument for measuring continuously oxygen saturation of arterial blood in man"، Review of Scientific Instruments، 13 (10): 434–444، Bibcode:1942RScI...13..434M، doi:10.1063/1.1769941.
- Severinghaus, John W.؛ Honda, Yoshiyuki (أبريل 1987)، "History of Blood Gas Analysis. VII. Pulse Oximetry" (PDF)، Journal of Clinical Monitoring، 3 (2): 135–138، doi:10.1007/bf00858362، PMID 3295125، مؤرشف من الأصل (PDF) في 16 نوفمبر 2008.
- Lin JC, Strauss RG, Kulhavy JC, et al. Phlebotomy overdraw in the neonatal intensive care nursery. Pediatrics Aug 2000;106(2):E19.
- Barker SJ (2002)، ""Motion-resistant" pulse oximetry: a comparison of new and old models"، Anesth Analg، 95 (4): 967–972، doi:10.1213/00000539-200210000-00033.
- Barker SJ, Shah NK (1997)، "The effects of motion on the performance of pulse oximeters in volunteers (revised publication)"، Anesthesiology، 86 (1): 101–108، doi:10.1097/00000542-199701000-00014.
- Jopling MW, Mannheimer PD, Bebout DE (2002)، "Issues in the laboratory evaluation of pulse oximeter performance"، Anesth Analg، 94: S62–68.
- Shah N, Ragaswamy HB, Govindugari K, Estanol L. Performance of three new-generation pulse oximeters during motion and low perfusion in volunteers. J Clin Anesth. May 22.
- Barker SJ (2002)، "Motion-resistant" pulse oximetry: a comparison of new and old models"، Anesth Analg، 95: 967–72، doi:10.1213/00000539-200210000-00033.
- Shah N, Ragaswamy HB, Govindugari K, Estanol L. Performance of three new-generation pulse oximeters during motion and low perfusion in volunteers. J Clin Anesth 2012
- Hay WW Jr, Rodden DJ, Collins SM, Melara DL, Hale KA, Fashaw LM (2002)، "Reliability of conventional and new pulse oximetry in neonatal patients"، J Perinatol، 22: 360–6، doi:10.1038/sj.jp.7210740.
- Castillo A, Deulofeut R, Critz A, Sola A (2010)، "Prevention of retinopathy of prematurity in preterm infants through changes in clinical practice and SpO(2)technology"، Acta Paediatr، 100: 188–92، doi:10.1111/j.1651-2227.2010.02001.x، PMC 3040295، PMID 20825604.
- Durbin CG, Rostow SK (2002)، "More reliable oximetry reduces the frequency of arterial blood gas analyses and hastens oxygen weaning after cardiac surgery: A prospective, randomized trial of the clinical impact of a new technology"، Crit Care Med، 30: 1735–40، doi:10.1097/00003246-200208000-00010.
- Taenzer AH, Pyke JB, McGrath SP, Blike GT (2010)، "The impact of pulse oximetry surveillance on rescue events and intensive care unit transfers a before-and-after concurrence study"، Anesthesiology، 112: 282–7، doi:10.1097/aln.0b013e3181ca7a9b، PMID 20098128.
- "Strategies for Implementing Screening for Critical Congenital Heart Disease" (PDF)، Pediatrics.aappublications.org، مؤرشف من الأصل (PDF) في 14 أكتوبر 2014، اطلع عليه بتاريخ 02 أبريل 2015.
- "Impact of pulse oximetry screening on the detection of duct dependent congenital heart disease: a Swedish prospective screening study in 39 821 newborns"، Bmj.com، 09 يناير 2009، مؤرشف من الأصل في 2 يونيو 2018، اطلع عليه بتاريخ 02 أبريل 2015.
- Pulse oximetry screening for congenital heart defects in newborn infants (PulseOx): a test accuracy study : The Lancet
- Mahle WT, Martin GR, Beekman RH 3rd, Morrow WR (12 نوفمبر 2014)، "Endorsement of Health and Human Services recommendation for pulse oximetry screening for critical congenital heart disease."، Pediatrics، 129: 190–2، doi:10.1542/peds.2011-3211، PMID 22201143.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Newborn CCHD Screening Progress Map | Updated 7/7/2014"، Cchdscreeningmap.org، مؤرشف من الأصل في 12 فبراير 2019، اطلع عليه بتاريخ 02 أبريل 2015.
- Pulse oximetry with clinical assessment to screen for congenital heart disease in neonates in China: a prospective study : The Lancet
- نسخة محفوظة 10 فبراير 2012 على موقع واي باك مشين.
- نسخة محفوظة 7 يناير 2009 على موقع واي باك مشين.
- "Home"، Anesthesiology.org، مؤرشف من الأصل في 9 أبريل 2020، اطلع عليه بتاريخ 02 أبريل 2015.
- Chung F, Liao P, Elsaid H, Islam S, Shapiro CM, Sun Y، "Oxygen desaturation index from nocturnal oximetry: a sensitive and specific tool to detect sleep-disordered breathing in surgical patients"، Anesth Analg، 114: 993–1000، doi:10.1213/ane.0b013e318248f4f5.
- De Felice C, Leoni L, Tommasini E, Tonni G, Toti P, Del Vecchio A, Ladisa G, Latini G (2008)، "Maternal pulse oximetry perfusion index as a predictor of early adverse respiratory neonatal outcome after elective cesarean delivery"، مجلة طب الأطفال الحرج، 9: 203–8، doi:10.1097/pcc.0b013e3181670021.
- De Felice C, Latini G, Vacca P, Kopotic RJ (2002)، "The pulse oximeter perfusion index as a predictor for high illness severity in neonates"، Eur J Pediatr، 161: 561–2، doi:10.1007/s00431-002-1042-5.
- De Felice C, Goldstein MR, Parrini S, Verrotti A, Criscuolo M, Latini G. Early dynamic changes in pulse oximetry signals in preterm newborns with histologic chorioamnionitis. مجلة طب الأطفال الحرج 2006;7:138–42.
- Takahashi S, Kakiuchi S, Nanba Y, Tsukamoto K, Nakamura T, Ito Y، "The perfusion index derived from a pulse oximeter for predicting low superior vena cava flow in very low birth weight infants"، J Perinatol، 30: 265–9، doi:10.1038/jp.2009.159.
- Ginosar Y, Weiniger CF, Meroz Y, Kurz V, Bdolah-Abram T, Babchenko A, Nitzan M, Davidson EM (2009)، "Pulse oximeter perfusion index as an early indicator of sympathectomy after epidural anesthesia"، Acta Anaesthesiol Scand، 53: 1018–26، doi:10.1111/j.1399-6576.2009.01968.x.
- Granelli AW, Ostman-Smith I (2007)، "Noninvasive peripheral perfusion index as a possible tool for screening for critical left heart obstruction"، Acta Paediatr، 96: 1455–9، doi:10.1111/j.1651-2227.2007.00439.x.
- Zimmermann M, Feibicke T, Keyl C, Prasser C, Moritz S, Graf BM, Wiesenack C (2009)، "Accuracy of stroke volume variation compared with pleth variability index to predict fluid responsiveness in mechanically ventilated patients undergoing major surgery"، Eur J Anaesthesiol، 27: 555–61.
- Cannesson M, Desebbe O, Rosamel P, Delannoy B, Robin J, Bastien O, Lehot JJ (أغسطس 2008)، "Pleth variability index to monitor the respiratory variations in the pulse oximeter plethysmographic waveform amplitude and predict fluid responsiveness in the operating theater"، Br J Anaesth، 101 (2): 200–6، doi:10.1093/bja/aen133.
- Forget P, Lois F, de Kock M. Goal-Directed Fluid Management Based on the Pulse Oximeter-Derived Pleth Variability Index Reduces Lactate Levels and Improves Fluid Management. Anesth Analg 2010.
- Ishii M, Ohno K؛ Ohno (1977)، "Comparisons of body fluid volumes, plasma renin activity, hemodynamics and pressor responsiveness between juvenile and aged patients with essential hypertension"، Jpn. Circ. J.، 41 (3): 237–46، doi:10.1253/jcj.41.237، PMID 870721.
- "[ARCHIVED CONTENT] NHS Technology Adoption Centre"، Ntac.nhs.uk، مؤرشف من الأصل في 5 فبراير 2016، اطلع عليه بتاريخ 02 أبريل 2015.
- نسخة محفوظة 12 أكتوبر 2014 على موقع واي باك مشين. [وصلة مكسورة]
- Pulse Oximetry نسخة محفوظة 20 سبتمبر 2017 على موقع واي باك مشين.
- "Pulse Oximetry"، مؤرشف من الأصل في 16 يوليو 2012.
- "Pulse Oximetry"، Oximetry.org، 10 سبتمبر 2002، مؤرشف من الأصل في 18 مارس 2015، اطلع عليه بتاريخ 02 أبريل 2015.
- "Principles of pulse oximetry"، Anaesthesia UK، 11 سبتمبر 2004، مؤرشف من الأصل في 24 فبراير 2015، اطلع عليه بتاريخ 24 فبراير 2015.
- Schlosshan, D؛ Elliott, M W (2004)، "Sleep 3: Clinical presentation and diagnosis of the obstructive sleep apnoea hypopnoea syndrome"، Thorax، 59: 347–352، doi:10.1136/thx.2003.007179، مؤرشف من الأصل في 31 مارس 2017.
- "FAR Part 91 Sec. 91.211 effective as of 09/30/1963"، Airweb.faa.gov، مؤرشف من الأصل في 19 يونيو 2018، اطلع عليه بتاريخ 02 أبريل 2015.
- HME Business News | HomeCare Magazine نسخة محفوظة 20 ديسمبر 2016 على موقع واي باك مشين.
- Fu ES, Downs JB, Schweiger JW, Miguel RV, Smith RA. Supplemental oxygen impairs detection of hypoventilation by pulse oximetry" Chest 2004;126:1552–8
- Barker SJ (2002)، ""Motion-resistant" pulse oximetry: a comparison of new and old models"، Anesth Analg، 95: 967–72، doi:10.1213/00000539-200210000-00033.
- Amalakanti, Sridhar؛ Pentakota, Mohan Rao (01 أبريل 2016)، "Pulse Oximetry Overestimates Oxygen Saturation in COPD"، Respiratory Care (باللغة الإنجليزية)، 61 (4): 423–427، doi:10.4187/respcare.04435، ISSN 0020-1324، PMID 26715772، مؤرشف من الأصل في 2 يونيو 2019.
- U.S. Market for Patient Monitoring Equipment. i Data Research. May 2012
- "Key Portable Medical Device Vendors Worldwide"، China Portable Medical Devices Report، بكين: ResearchInChina، ديسمبر 2008.
- Pigna, Kris (02 يونيو 2009)، "Satoru Iwata Announces Wii Vitality Sensor"، 1UP.com، مؤرشف من الأصل في 8 مارس 2020، اطلع عليه بتاريخ 02 يونيو 2009.
- "Nintendo Introduces New Social Entertainment Experiences at E3 Expo"، Nintendo of America، 02 يونيو 2009، مؤرشف من الأصل في 08 أبريل 2009، اطلع عليه بتاريخ 02 يونيو 2009.
- Apple Watch teardown reveals pulse oximeter, suggesting future measurement of blood oxygen | 9to5Mac نسخة محفوظة 07 ديسمبر 2017 على موقع واي باك مشين.
- Your heart rate. What it means, and where on Apple Watch you’ll find it. - Apple Support نسخة محفوظة 11 فبراير 2018 على موقع واي باك مشين.
- How accurate is the Apple Watch heart-rate monitor? This accurate … | 9to5Mac نسخة محفوظة 19 ديسمبر 2017 على موقع واي باك مشين.
- Cannesson, M.؛ Desebbe, O.؛ Rosamel, P.؛ Delannoy, B.؛ Robin, J.؛ Bastien, O.؛ Lehot, J.-J. (2008)، "Pleth variability index to monitor the respiratory variations in the pulse oximeter plethysmographic waveform amplitude and predict fluid responsiveness in the operating theatre"، British Journal of Anaesthesia، 101 (2): 200–206، doi:10.1093/bja/aen133، ISSN 0007-0912.
روابط خارجية
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة طب
- بوابة علم وظائف الأعضاء
