كلوريد أنتيموان خماسي
كلوريد أنتيموان خماسي (بالإنجليزية: Antimony pentachloride) مركب كيميائي له الصيغة SbCl5 ، ويكون على شكل سائل عديم اللون إلى أصفر .
| كلوريد أنتيموان خماسي | |
|---|---|
 كلوريد أنتيموان خماسي | |
| الاسم النظامي (IUPAC) | |
كلوريد أنتيموان خماسي | |
| أسماء أخرى | |
? | |
| المعرفات | |
| رقم CAS | 7647-18-9 |
| بوب كيم | 24294 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | SbCl5 |
| الكتلة المولية | 299.024 غ/مول |
| المظهر | سائل عديم اللون إلى أصفر |
| الكثافة | 2.34 غ/سم3 |
| نقطة الانصهار | 4 °س |
| نقطة الغليان | 140 °س |
| الذوبانية في الماء | يتفاعل |
| الذوبانية | ? |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التفاعلات
تحلل خماسي كلوريد الأنتيمون لإعطاء حمض الهيدروكلوريك وأوكسي كلوريد الأنتيمون. يتم قمع هذا التفاعل في حالة وجود فائض كبير من الكلوريد، بسبب تكوين أيون مركب سداسي كلورو أنتيمونات:
-[SbCl5 + Cl− → [SbCl6
أن أحادي ورباعي هيدرات معروفة، SbCl5·4H2O و SbCl5.H2O
هذه الأشكال المركبة تقترب من العديد من قواعد لويس. SbCl5 هو حمض لويس ناعم ومعلمات نموذج ECW الخاص به هي EA = 3.64 و CA = 10.42. يتم استخدامه كحمض لويس القياسي في مقياس جوتمان لأساسيات لويس. ومع ذلك، توضح مخططات Cramer-Bopp أن مقياس الأساسي أحادي المعلمة غير مكتمل وأنه لا يوجد ترتيب واحد لقوة القاعدة. توضح هذه المخططات أنه لتحديد ترتيب قوة قاعدة لويس (أو قوة حمض لويس) يجب مراعاة خاصيتين على الأقل.
كما أنه عامل مؤكسد قوي.
التحذيرات
خماسي كلوريد الأنتيمون مادة شديدة التآكل يجب تخزينها بعيدًا عن الحرارة والرطوبة. وهو عامل كلور، وفي وجود الرطوبة يطلق غاز كلوريد الهيدروجين. لهذا السبب، قد تخرم حتى أدوات الفولاذ المقاوم للصدأ (مثل الإبر)، إذا تم التعامل معها في جو رطب. لا ينبغي التعامل معها بالبلاستيك غير المفلور (مثل المحاقن البلاستيكية، أو الحواجز البلاستيكية، أو الإبر ذات التركيبات البلاستيكية)، لأنها تذوب وتفحم المواد البلاستيكية.
التحضير
يتم تحضير خماسي كلوريد الأنتيمون عن طريق تمرير غاز الكلور إلى ثلاثي كلوريد الأنتيمون المنصهر:
SbCl3 + Cl2 → SbCl5
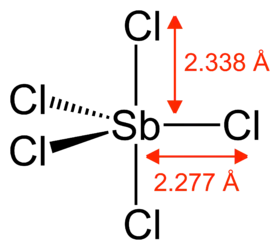
يحتوي SbCl5 الغازي على هيكل ثلاثي الهرمي.
الاستخدامات
يستخدم خماسي كلوريد الأنتيمون كمحفز للبلمرة ولكلورة المركبات العضوية.