مركب بروم عضوي
مركبات البروم العضوية هي مركبات عضوية تحتوي على كربون مرتبط مع عنصر البروم.[1] أكثرها انتشارا هو برومو الميثان وهو ينتج طبيعيا.أحد أبرز الإستخدامات هو استخدام مركبات ثنائي الفينيل متعددة البروم كمثبطات للحريق. تم العثور على مجموعة متنوعة من مركبات عضوبرومينية ثانوية في الطبيعة. ولكنها غير ناتجة عن تخليق حيوي.المركبات العضوبرومينية أصبحت تحت المراقبة لما لها من آثار ضارة على البيئة.
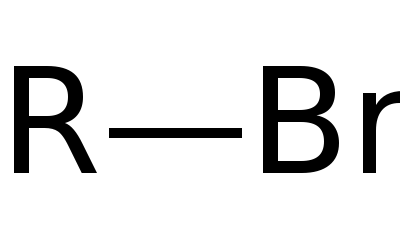 الصيغة العامة للمركبات العضوبرومية. ذرة البروم مرتبطة بجذر كيميائي عضوي.
الصيغة العامة للمركبات العضوبرومية. ذرة البروم مرتبطة بجذر كيميائي عضوي.
الخصائص العامة
أكثر المركبات العضوبرومينية هي مثل غالبية الهاليدات العضوية فهي غير القطبية نسبيا. البروم هو أكثر كهروسالبية من الكربون (2.8 مقابل 2.5). وبالتالي، فإن الكربونة المرتبطة بالبرومين تكون ذات خاصية إلكتروفيلية. كمثال ألكيل البروميد هو عامل ألكلة.
طرق التحضير
من البرومين
تتم الإضافة على الرابطة الثنائية في الألكينات بدون عوامل حفازة ليعطي الناتج ثنائي بروميد متجاور.
RCH=CH2 + Br2 → RCHBrCH2Br
المركبات العطرية تخضع للهلجنة من قبل البروم وذلك في وجود عوامل حفازة مثل AlBr3 أو FeBr3 حتى يحدث التفاعل على الحلقات العطرية.
RC6H5 + Br2 → RC6H4Br + HBr
التطبيق البارز لهذا النوع من التفاعلات هو إنتاج مركب رباعي برومو ثنائي فينول أ (Tetrabromobisphenol A)من ثنائي فينول أ (Bisphenol A). ويدخل البروم في تفاعل استبدال الجذر الحر (الراديكال) لإعداد المركبات العضوبرومينية. ويكون الجزء العضوي عادة هو مركبات تحوي مجموعة الكربونيل، أوالبنزيل، أو الأليل. على سبيل المثال يتم إنتاج برومو حمض الخل مباشرة من تفاعل حمض الخليك مع البرومين في وجود ثلاثي بروميد الفسفور كعامل حفاز.
CH3CO2H + Br2 → BrCH2CO2H + HBr
من بروميد الهيدروجين
تتم إضافة بروميد الهيدروجين على الرابطة الثنائية على حسب قاعدة ماركونيكوف
RCH=CH2 + HBr → RCHBrCH3
في ظل وجود ظروف تكوين الجذور الحرة تتم الإضافة عكس قاعدة ماركونيكوف. إضافة الجذر الحر تستخدم تجارياً لإنتاج 1-بروموالكان الذي ينتج الأمينات الثلاثية وأملاح الأمونيوم الرباعية. ويتم إنتاج 2-فينيل بروميد (C6H5CH2CH2Br) من الستايرين بنفس هذه الطريقة. ويمكن أيضا استخدام بروميد الهيدروجين لتحويل الكحول إلى بروم ألكيل.ويحدث هذا التفاعل عند ظروف درجات حرارة منخفضة لتخليق بروميد الآليل.
HOCH2CH=CH2 + HBr → BrCH2CH=CH2 + H2O
من أملاح البروميد
أيونات البروميد، مثل أيونات بروميد بعض كبروميد الصوديوم، تكون بمثابة نيكلوفيل وذلك لتكوين مركبات عضوبرومينية عن طريق النزوح.
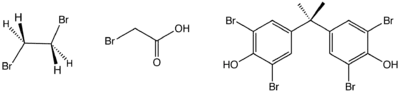 الأشكال البنائية لثلاثة من أهم المركبات العضوبرومية في الصناعة من اليسار إالى اليمين: بروميد الإيثيلين, برومو حمض الخل و رباعي برومو ثنائي فينول أ.
الأشكال البنائية لثلاثة من أهم المركبات العضوبرومية في الصناعة من اليسار إالى اليمين: بروميد الإيثيلين, برومو حمض الخل و رباعي برومو ثنائي فينول أ.
المركبات العضوبرومية ذات أهمية صناعية
لإخماد للحرائق
تستخدم بشكل واسع لإخماد الحرائق. والمركب الأكثر بروزاً لهذا الاستخدام هو
(tetrabromobisphenol-A (4,4'-(1-methylethylidene)bis-(2,6-di-bromophenol
كمواد لقتل الآفات بالتبخير ببخارها وكمبيدات حيوية
بروميد الإيثيلين، يتم إنتاجه من إضافة البروم إلى الإيثيلين وكانت له أهميته التجارية حيث كان يستخدم كأحد مكونات البنزين المحتوي على الرصاص. كان أيضاً شائع الاستعمال في الأعمال الزراعية حيث كان بخاره يستخدم للتبخير. بروميد الميثيل هو أيضا عامل تبخير فعال، ولكن يتم التحكم في إنتاجه واستخدامه من قبل بروتوكول مونتريال. يتزايد استخدام المركبات العضوبرومينية كمبيدات حيوية لمعالجة المياه. وذلك يتضمن البروموفورم (ثلاثي برومو الميثان) و (”dibromodimethylhydantoin (“DBDMH.
الأصباغ
العديد من الصبغات تحتوي على مركبات محتوية على كربون مرتبط مع برومين. قبل تطور صناعة الأصباغ في أواخر القرن التاسع عشر، كان أرجوان صور (6,6’-dibromoindigo)كانت صبغة قيمة متواجدة طبيعياً. وتستخدم العديد من مشتقات الأنثراكينون المبرومة تجارياً. أزرق البروموثيمول هو دليل لوني ذو شعبية في الكيمياء التحليلية.
المستحضرات الصيدلانية
كأمثلة على بعض المستحضرات الصيدلانية العضوبرومينية المتاحة تجارياً، نيسرجولين (nicergoline)الموسع للأوعية، بروتيزولام (Brotizolam) كمهدئ، بيبوبرومان (Pipobroman) كعامل مضاد للسرطان، ووميربرومين (merbromin) كمطهر. خلاف ذلك المركبات العضوبرومينية نادراً ماتكون مفيدة طبياً على عكس المركبات العضوفلورينية.
المركبات العضوبرومينية في الطبيعة
المركبات البرومية العضوية هي أكثر انتشارا في الكائنات البحرية من المشتقات الكلورية العضوية، ووفرتها يرجع إلى سهولة اكسدتها من بروميد إلى مايكافئه من ايونات بروم +Br, وهو الكتروفيل قوي. إنزيم Bromoperoxidase يحفز هذا التفاعل. وتطلق المحيطات بما يقدر بـ 1-2 مليون طن من ثلاثي برومو الميثان و56،000 طن من برومو الميثان سنويا.
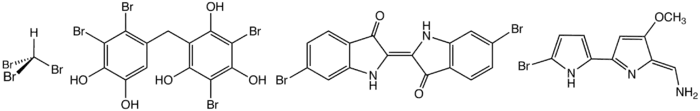 الاشكال البنائية لبعض المركبات العضوبرومينية المتواجدة في الطبيعة. من اليسار: ثلاثي برومو الميثان, ثنائي فينول مبروم, ثنائي برومو إنديجو(الأرجوان الصور),و the antifeedant tambjamine B.
الاشكال البنائية لبعض المركبات العضوبرومينية المتواجدة في الطبيعة. من اليسار: ثلاثي برومو الميثان, ثنائي فينول مبروم, ثنائي برومو إنديجو(الأرجوان الصور),و the antifeedant tambjamine B.
الأمان
بروميدات الألكيل غالباً ماتكون عوامل ألكلة مناسبة والمشتقات الأروماتية المبرومة تتسبب في اختلال الهرمونات. من المركبات الشائع انتاجها، ثنائي البروميد الاثيلين وهو من أكبر مصادر القلق حيث أنه شديد السمية ومسرطن للغاية.
المراجع
- "معلومات عن مركب بروم عضوي على موقع ebi.ac.uk"، ebi.ac.uk، مؤرشف من الأصل في 13 ديسمبر 2019.
- بوابة الكيمياء