مركب ليثيوم عضوي
مركبات الليثيوم العضوية عبارة عن مركبات عضوية لفلز الليثيوم.[1]

التحضير
يمكن لهذه المركبات أن تحضّر من خلال:
التفاعل مع الهالوجينات
إن مركبات الليثيوم الألكيلية والأريلية يمكن أن تحضّر من تفاعل الهاليدات مع عنصر الليثيوم.
- R = باقي عضوي، X = هالوجين.
الهاليدات المستخدمة يمكن أن تكون كلوريد أو بروميد أو يوديد. يحدث تفاعل فورتز كتفاعل جانبي:
- تفاعل فورتز
يمكن استخدام مركبات عضوية متوفرة تجارياً كعوامل لإضافة الليثيوم إلى المركبات العضوية. يحدث نتيجة لذلك تفاعل تبادل ويتشكل مركب الليثيوم العضوي بالإضافة إلى الهاليد الموافق.
- إضافة الليثيوم إلى الأريل، Ar = أريل، X = هاليد.
من انفصام الرابطة C-H
يمكن تحضير مركبات الليثيوم العضوية من عملية نزع بروتون من مادة ليثيوم عضوية مثل ن-بوتيل الليثيوم. في هذه الحالة ينزع بروتون نشيط نتيجة المركب العضوي لليثيوم، مشكلاً بذلك مركب الليثيوم العضوي المطلوب، ويتحرر بذلك ألكان خلال هذه العملية.

يتطلب هذا التفاعل أن يكون لمركب اللثيوم العضوي المتشكل قاعدية أضعف من المركب الأصلي، حيث أنه عندما تكون قاعدية المركب العضوي المضاف أقوى، فإنه بالتالي يتفاعل بانتقائية أقل، ويكون بالتالي البروتون المنتزع أكثر حمضية من البروتونات الأخرى المتوفرة.
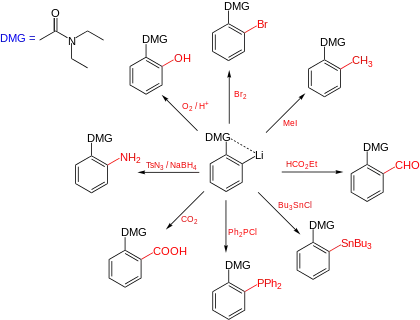
يمكن إضافة الليثيوم إلى الهيدروكربونات العطرية عبر مجموعات موجّهة إلى الموقع أورثو مثل مجموعة الأمين أوالأميد أوالميثوكسي. هذه المجموعات لديها زوج إلكتروني حر يقوم بتثبيت أيون الليثيوم وبالتالي يوجه الليثيوم إلى بروتون الموقع أورثو، الذي يفضل الانتزاع.

هذا التأثير مشابه لانتقائية أورثو في تفاعل كولبة-شميت المستخدم لتحضير حمض الساليسيليك.
الخواص

نتيجة فرق الكهرسلبية الكبير بين اللليثيوم (0.98) والكربون (2.55) فإن لمركبات الليثيوم العضوية صفة أيونية، حيث أن عزم ثنائي قطب المقاس يبلغ 6 ديباي، في حين أنه للرابطة الأيونية حوالي 9 ديباي، بالتالي فإن هذه الرابطة هي رابطة تساهمية مستقطبة. إن الرابطة بين الليثيوم والكربون مستقطبة بشكل كبير حيث تحمل ذرة الكربون الشحنة السالبة وتتصف بذلك بصفات الكربانيون.
نادراً ما تكون مركبات الليثيوم في المحاليل على شكل أحادي، حيث أن تتكتل على بعضها البعض في تشكيلات مرتبة. تعود هذه التشكيلات إلى نقص الإشباع التساندي لليثيوم في رابطة من النوع 2-إلكترون-2-مركز. لذلك فإن مركبات الليثيوم العضوية تشكل قليل وحدات (أوليغوميرات) للوصلل إلى حالة الإشباع التساندي. على سبيل المثال، فإن ن-بوتيل الليثيوم يشكّل رباعي وحدات في ثنائي إيثيل الإيثر وسداسي وحدات في حلقي الهكسان.
تتفاعل مركبات الليثيوم العضوية بشكل عنيف مع الماء حيث أن لها صفة قاعدية قوية
- تفاعل بوتيل الليثيوم مع الماء حيث يتشكل البوتان وهيدروكسيد الليثيوم.
إن لبعض مركبات الليثيوم العضوية مثل ثالثي بوتيل الليثيوم لها صفات تلقائية الاشتعال.
الاستعمال
إن الليثوم لا يعد من الفلزات النبيلة، لذلك فإنه من الممكن إجراء تفاعل تبادل فلزي. تستعمل هذه الخاصة من أجل تحضير معقدات شروك الكربينية. أما الباقي فتستعمل في تفاعل استبدال مع ربيطات ذات نشاط عال.

في مثال آخر، تستخدم هذه المركبات لتحضير مركبات النحاس العضوية:
إن الصفة الكهرسلبية لذرة الكربون في هذه المركبات تمكّن من استخدامها ككواشف محبة للنواة، حيث يمكن أن تضاف إلى الألكتروفيلات من أجل تفاعلات الإضافة. بالتالي، تضاف مركبات الليثيوم العضوية إلى الكيتونات والألدهيدات ويحدث تفاعل استبدال مع الإسترات.
إن مركبات الليثيوم العضوية العطرية تكون مناسبة للدخول في في تفاعلات استبدال عطرية، مثل تفاعلات الألكلة وإضافة البروم واليود وإضافة الكربوكسيل. كما تستخدم هذه المركبات في تفاعل سوزوكي وفي تحضير مركبات الزنك العضوية المستخدمة في تفاعل ستايل.
مصادر
- "معلومات عن مركب ليثيوم عضوي على موقع britannica.com"، britannica.com، مؤرشف من الأصل في 19 ديسمبر 2019.
- Christoph Elschenbroich|C. Elschenbroich: Organometallchemie, 6. Auflage, Vieweg+Teubner Verlag, 2008, ISBN 3-8351-0167-6.
- A. Salzer: Organometallic compounds, in: Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH Weinheim.