نظرية برونستد-لوري
نظرية برونستد-لوري (Brønsted–Lowry acid–base theory) هي نظرية في تفاعلات الحموض مع القواعد اقترحها كُلٌ من العالمين الدنماركيّ يوهانس نيكولاوس برونستد والإنجليزيّ توماس مارتن لوري على حدة عام 1923. المفهوم الأساسيّ لهذه النظرية هو أنّه عند تفاعل حمض مع قاعدة فإن الحمض يكوّن قاعدةً مُرافقةً بينما تكوّن القاعدة حمضاً مُرافقاً من خلال تبادل بروتون (أيونات الهيدروجين الموجبة أو H+). وبذلك تُمثل هذه النظرية تعميماً لنظرية أرهينيوس.
  | |
| طرح العالمان يوهانس نيكولاوس برونستد وتوماس مارتن لوري بشكلٍ مُستقل فكرة أنّ الأحماض هي مواد مانحة للبروتونات في حين أنّ القواعد مُستقبلة لها. |
تعريفات الحموض والقواعد
عُرّفت الحموض وفقاً لنظرية أرهينيوس على أنها مواد كيميائية تتفكك في المحاليل المائية فتزيد من تركيز أيونات الهيدروجين (H+) فيها. أمّا القواعد فعُرّفت على أنها مواد كيميائية تتفكك في المحاليل المائية فتزيد من تركيز أيونات الهيدروكسيد (OH−) فيها.[1][2]
اقترح عالما الكيمياء الفيزيائية يوهانس نيكولاوس برونستد في الدنمارك وتوماس مارتن لوري في إنجلترا عام 1923 مُستقليّن نظريةً حملت اسمهما.[3][4][5] قدّمت هذه النظرية تعريفاً جديداً للحموض والقواعد بناءً على طريقة تفاعلهما مع بعضهما البعض لتكون بذلك أعمّ وأشمل من النظريات التي سبقتها.[6] ويُمكن التعبير عن هذا التعريف من خلال المعادلة الكيميائية التالية:
- حمض + قاعدة
 قاعدة مُرافقة + حمض مُرافق.
قاعدة مُرافقة + حمض مُرافق.
وإذا أعطينا الحمض الرمز HA والقاعدة الرمز B فإنه يُمكن كتابة المُعادلة بالرموز على النحو التالي:
استُخدمت علامة الاتزان (السهمين المُتعاكسين) في المُعادلة لأنّ التفاعل يُمكن أن يحدث بالاتجاهين الأمامي والعكسي، أي أنّ المواد المُتفاعلة قد تؤول إلى النواتج أو قد تؤول النواتج إلى المواد المُتفاعلة. يُمكن للحمض HA أن يفقد بروتوناً ليُكوّن قاعدةً مُرافقةً له A-. ويُمكن للقاعدة B أن تستقبل بروتوناً لتكوّن حمضاً مُرافقاً لها HB+. مُعظم تفاعلات الحموض مع القواعد تكون سريعةً وبالتالي تكون المواد الداخلة في التفاعل عادةً في حالة اتزان ديناميكي مع بعضها البعض.[7]
المحاليل المائية

بالنظر في تفاعل الحمض والقاعدة التالي:
نُلاحظ أنّ حمض الإيثانويك (CH3COOH) يُعد حمضاً لأنه يمنح بروتوناً لجُزيء الماء (H2O) مُكوّناً قاعدته المُرافقة أيون الإيثانوات (CH3COO-). كذلك يُعد الماءُ في هذا التفاعل قاعدةً لأنه يستقبل بروتوناً من حمض الإيثانويك مُكوّناً حمضه المُرافق أيون الهيدرونيوم (H3O)+.[8]
التفاعل العكسي لتفاعل حمض مع قاعدة هو أيضاً تفاعل حمض مع قاعدة، إذ يتفاعل الحمض المُرافق للقاعدة في التفاعل الأول مع القاعدة المُرافقة للحمض. ففي المثال السابق يكون أيون الإيثانوات هو القاعدة في التفاعل العكسي بينما يكون أيون الهيدرونيوم هو الحمض.
مزيّة نظرية برونستد - لوري أنها -على العكس من نظرية أرينيوس- لا تتطلب تفكك الأحماض وبالتالي لا تقتصر على المحاليل المائية.[9]
المواد الأمفوتيرية
| أحماض وقواعد |
|---|
 |
|
| أنماط الحموض |
|
| أنماط القواعد |
|
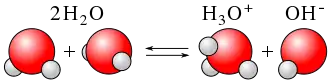
يُمكن القول استناداً إلى نظرية برونستد - لوري أنّ الحمض إنما يكون حمضاً اعتماداً على علاقته (تبادل البروتون) بالقاعدة، والعكس صحيح. فالماء أمفوتيري لأنه قد يسلك سلوك الحمض وقد يسلك سلوك القاعدة. ففي الصورة الظاهرة في اليسار يسلك أحد جزيئي الماء سلوك القاعدة ويكتسب بروتوناً من الجُزيء الآخر مُكوّناً +H3O في حين يسلك الجُزيء الآخر سلوك الحمض ويفقد بروتوناً مُكوّناً -OH. وتُعرف هذه الظاهرة بالتأين الذاتي للماء.[10]
ومن الأمثلة على المواد الأمفوتيرية أيضاً هيدروكسيد الألومنيوم (Al(OH)3).
حيث يُعدّ هيدروكسيد الألومنيوم هنا حمضاً.
بينما يكون هيدروكسيد الألومنيوم هنا قاعدة.
المحاليل غير المائية
يُعد أيون الهيدروجين (أو أيون الهيدرونيوم) حمض برونستد - لوري في المحاليل المائية، بينما يُعد أيون الهيدروكسيد قاعدةً بفضل تفاعل التفكك الذاتي.
كما يحدث تفاعلٌُ مُشابهٌ في الأمونيا السائلة.
وبالتالي فإنّ أيون الأمونيوم (+NH4) في الأمونيا السائلة يلعب الدور ذاته الذي يلعبه أيون الهيدرونيوم في الماء، في حين يُشابه دور أيون الأميد (-NH2) دور أيون الهيدروكسيد. أي أنّ أملاح الأمونيوم تسلك سلوك الحمض والأميدات تسلك سلوك القاعدة.[11]
كما يُمكن أن تسلك بعض المذيبات سلوك القاعدة (أي مُستقبلة للبروتونات) اعتماداً على علاقتها بحمض برونستد - لوري.
حيث S تُشير إلى جُزيء المُذيب. وعندما يكون المُذيب أقوى كمُستقبلٍ للبروتونات من الماء فإنّ الحمض يُصبح حمضاً أقوى في هذا المُذيب منه في الماء.[12] حتى أنّ كثيراً من الجزيئات تسلك سلوك الحمض في المحاليل غير المائية ولا تسلك ذلك في المحاليل المائية. يُمكن أن تسلك بعض المُذيبات سلوك الحمض أيضاً، علماً أنّ المُذيب الحمضي يزيد من قاعدية المواد الذائبة فيه. فالمُركب COOHCH3 -على سبيل المثال- المعروف بحمض الإيثانويك نظراً لسلوكه الحمضيّ في الماء يسلك سلوك القاعدة في كلوريد الهيدروجين السائل نظراً لكونه مُذيباً أكثر حامضيةً بكثير.[13]
مقارنة مع نظرية لويس للحموض والقواعد
في نفس العام الذي نشر فيه برونستد ولوري نظريتهما اقترح العالم الأمريكي جيلبرت نيوتن لويس نظريةً بديلةً لتفاعلات الحموض مع القواعد. تعتمد نظرية لويس على التركيب الإلكتروني، حيث تُعرف القاعدة حسب مفهوم لويس على أنها مُركب له القُدرة على منح زوج من الإلكترونات إلى حمض لويس، وهو المُركب القادر على استقبال زوج من الإلكترونات.[14][15] أي أنّ اقتراح لويس يُعطي تفسيراً لنظرية برونستد - لوري من حيث التركيب الإلكتروني.
نُلاحظ في هذه المُعادلة أنّ كُلاً من القاعدة B والقاعدة المُرافقة A- تحمل زوجاً واحداً من الإلكترونات في حين أنّ البروتون -وهو حمض لويس- قد انتقل بينهما.

كتب لويس في وقت لاحق يقول: (إنّ حصر مجموعة الحموض بتلك المواد المُحتوية على الهيدروجين يُؤثر بشكل كبير على فهمنا المنهجيّ للكيمياء تماماً كحصر مًصطلح العامل المؤكسد بالمواد المُحتوية على الأكسجين).[15] يتفاعل الحمض A والقاعدة B حسب نظرية لويس لتكوين ناتج الإضافة AB. ويُستخدم زوج الإلكترونات في هذا التفاعل لتكوين رابطة تناسقية بين A وB. مثالٌ على ذلك تكوّن ناتج الإضافة H3N-BF3 من الأمونيا (NH3) وثلاثي فلوريد البورون (BF3)،[10] علماً بأنّ هذا التفاعل لا يُمكن أن يحدث في المحاليل المائية لأنّ ثلاثي فلوريد البوربون يتفاعل بشدة مع الماء في تفاعل الحلمهة.[16]
يُعد حمض البوريك حمض لويس، ويُمكن تبيين ذلك من خلال التفاعل التالي:
لا يتفكك الحمض في هذه الحالة، بل القاعدة (الماء) هي التي تتفكك. ويكون محلول 3(B(OH حمضياً لأنّ التفاعل ينتج عنه تحرر أيونات الهيدروجين.
هناك أدلةٌ قويّةٌ تُشير إلى أنّ المحاليل المائية المُخففة للأمونيا تحتوي على كميات ضئيلة جداً لا تكاد تُذكر من أيونات الأمونيوم.
وعندما تتفكك الأمونيا في الماء فإنها تعمل كقاعدة لويس.[17]
مقارنة مع نظرية لوكس - فلود
هناك تفاعلات بين أكاسيد مُعيّنة في المحاليل غير المائية لا يُمكن تفسيرها على أساس نظرية برونستد - لوري. فعلى سبيل المثال التفاعل:
لا يدخل في نطاق تعريف برونستد - لوري للحموض والقواعد. ومع ذلك فإنّ أكسيد المغنسيوم (MgO) قاعديّ بينما ثنائي أكسيد السيليكون (SiO2) حمضيّ طبقاً لبرونستد - لوري، إذ يتبين ذلك عند خلطهما في الماء. مع العلم أنّ نظرية لوكس - فلود تُعرف الحموض على أنها مواد مُستقبلة لأيون الأكسيد (O−2) في حين أنّ القواعد هي مواد مانحة لأيون الأكسيد.[18] ويعد هذا التصنيف ذا أهمية في مجال الجيوكيمياء.
المراجع
- Myers, Richard (2003)، The Basics of Chemistry، Greenwood Publishing Group، ص. 157–161، ISBN 978-0-313-31664-7، مؤرشف من الأصل في 27 نوفمبر 2019.
- كتاب الكيمياء للصف الثاني عشر المنهاج الفلسطيني - صفحة 153 نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين.
- Masterton؛ Hurley؛ Neth (2011)، Chemistry: Principles and Reactions، Cengage Learning، ص. 433، ISBN 1-133-38694-6، مؤرشف من الأصل في 22 مارس 2020.
- Ebbing؛ Gammon (2010)، General Chemistry, Enhanced Edition، Cengage Learning، ص. 644–645، ISBN 0-538-49752-1، مؤرشف من الأصل في 22 مارس 2020.
- Whitten؛ Davis؛ Peck؛ Stanley (2013)، Chemistry، Cengage Learning، ص. 350، ISBN 1-133-61066-8، مؤرشف من الأصل في 23 يناير 2020.
- كتاب الكيمياء للصف الثاني عشر المنهاج الفلسطيني - صفحة 156 نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين.
- Lew (2009)، Acids and Bases، Infobase Publishing,، ISBN 9780791097830، مؤرشف من الأصل في 12 مايو 2016.
{{استشهاد بكتاب}}: صيانة CS1: extra punctuation (link) - Patrick, Graham (2012)، Instant Notes in Organic Chemistry، Taylor & Francis، ص. 76، ISBN 978-1-135-32125-3، مؤرشف من الأصل في 23 يناير 2020.
- أسرار الكيمياء [وصلة مكسورة] نسخة محفوظة 13 أبريل 2020 على موقع واي باك مشين.
- كتاب الكيمياء للصف الثاني عشر المنهاج الفلسطيني - صفحة 157 نسخة محفوظة 05 مارس 2016 على موقع واي باك مشين.
- Holliday؛ Massy (1965)، Inorganic Chemistry in Non-Aqueous Solvents، Pergamon Press.
- "Bordwell pKa Table (Acidity in DMSO)"، مؤرشف من الأصل في 9 أكتوبر 2008، اطلع عليه بتاريخ 02 نوفمبر 2008.
- Waddington (1965)، Non-Aqueous Solvent Systems، New York: Academic Press.
- Miessler, G. L., Tarr, D. A., (1991) "Inorganic Chemistry" 2nd ed. Pearson Prentice-Hall pp. 170–172
- Hall, Norris F. (مارس 1940)، "Systems of Acids and Bases"، Journal of Chemical Education، 17 (3): 124–128، Bibcode:1940JChEd..17..124H، doi:10.1021/ed017p124.
- LABORATORY CHEMICAL SAFETY SUMMARY: BORON TRIFLUORIDE نسخة محفوظة 18 يوليو 2015 على موقع واي باك مشين.
- Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (2nd ed.). Prentice Hall. p. 187
- Drago, Russel S.؛ Whitten, Kenneth W. (1966)، "The Synthesis of Oxyhalides Utilizing Fused-Salt Media"، Inorg. Chem.، 5 (4): 677–682، doi:10.1021/ic50038a038.
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء