يدوية (كيمياء)
الجزيء اليدواني[1] أو الكيرالي أو عدم التناظر المرآتي[2] أو التصاوغ الضوئي[3] أو الصفة اليدوية[3] لا ينطبق على صورته في المرآة حتى إذا دوّر حول نفسه.

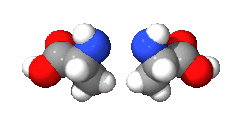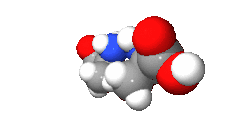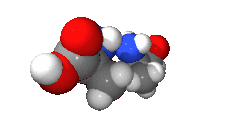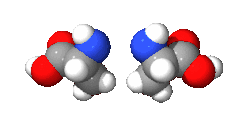
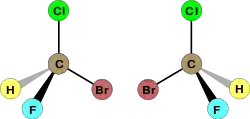
واليد مثال لذك فهي يدوانية، فاليد اليسرى هي صورة مرأة لليد اليمنى ولكن لا يمكن أن ينطبقا حتى ولو تم تدويرهم بأى درجة في نفس المستوى (شاهد الشكل بالأسفل). وتوصف الجزيئات اليدوانية بأنها يمينية أو يسارية.
دراسة اليدوانية تندرج ضمن إطار الكيمياء الفراغية. ويطلق على الجزيئين الذي لا يحدث لهما انطباق، وهما مرآة لبعض، اسم المتخايل[4] (enantiomer). ويكون للمركبات اليدوانية نشاط ضوئي، ولذلك فالمتخايل له اسم آخر وهو متزامر ضوئي (optical isomer). ويصنف كل متخايل أن له دوران لليمين، أو دوران لليسار اعتمادا على ما إذا كان يسبب دوران للضوء المستقطب ناحية اليمين أو ناحية اليسار. والمخلوط الذي يحتوى على 50/50 من كل نوع من المتخايل يسمى مخلوط راسمي ولا يوجد له نشاط ضوئي. كما أنه يمكن أيضا تسمية الجزيء اليدواني «غير متناظر», فإن اليدوانية وعدم التناظر لهما نفس المعنى.
ولتعريف أكثر دقة من الناحية التقنية، فإن تماثل جزيء (أو أي كائن أخر) يحدد ما إذا كان يدوانيا أم لا. ويكون الجزيء يدواني بشرط أنه لا يوجد له مستوى تماثل، أي أن أي محاولة لتقسيم الجزيء لقسمين متشابهين لا تنجح، (مثلا البروموكلوروفلوروكربون - لايمكن فصل الجزيء لقسمين متساويين)، ويصبح الجزيء لايدوانيا[5] في حالة تواجد مستوى يمكن أن يقسم الجزيء لقسمين متساويين.
بصفة عامة ليس شرطا كون الجزيء يدوانيا أن يكون غير متماثل على الإطلاق، لأنه يمكن للجزيء اليدواني أن يكون به تماثل في الدوران. وعموما فإن كل الأحماض الأمينية التي تتواجد بصفة طبيعية (فيما عدا الغليسين) وعديد من السكرات تكون غير متماثلة في نفس الوقت الذي تكون فيه يدوانية. ويمكن لليدوانية أن تعرف أيضا عن طريق التعريفات الرياضية.
اليدوانية لها أهمية كبيرة في الكيمياء كما انها توحد التعريفات التقليدية لفروع الكيمياء كيمياء غير عضوية. كيمياء عضوي، كيمياء فيزيائية. وكثير من الجزيئات الحيوية يدواني، بما فيه الأحماض الامينية الطبيعية، (وحدات بناء البروتينات), والفيتامينات. ومن المثير للدهشة أن جميع هذه المركبات لها نفس النوع من اليدواني (chirality) يدواني متجانس (homochiral). وأصل توحد هذه الجزيئات في اليدواني في العالم الحيوي لا يزال تحت الجدل الواسع. عديد من المركبات التناسقية يكون أيضا يدواني، فمثلا معقد [Ru(2,2'-bipyridine)3]2+ والذي فيه يكون ليجند البيريدين يماثل المروحة.
الإنزيمات، عادة ما تكون يدواني، ويمكن التفريق بين 2 إنانتومر (enantiomer) لأى إنزيم يدواني. ويمكن تصور ذلك بتخيل الإنزيم كقفاز، ولو أن هذا القفاز لليد اليمني فإن الجزيئات اليمينية ستدخل فيه بسهولة، وسيكون بينهما ارتباط بطريقة سهلة ومحكمة. وعلى العكس فإن جزيئات اليد اليسرى لن تدخل فيه. وبالرغم من أن هذا المثال يبسط العملية للغاية إلا أنه قد يعبر عن عامة: المركبات اليدواني لها نشاط مختلف مع المتقابلات الضوئية للمركبات اليدواني الأخرى.
وقد تحدث بعض العمليات الحيوية فقط بواحد فقط من المقابلات الضوئية لجزيء يدواني، وغالبا لا تستجيب للمقابل الأخر. فمثلا إس-كارفون («يساري») هو المذاق المميز للكراويه، بينما أر-كارفون («يميني») هو المذاق الخاص بالنعناع. وكثير من الأدوية يجب أن تصنع بنقاء كبير للمقابلات الضوئية، نظرا لسمية المقابل الضوئي الخطأ. زمثال لذلك ثاليدوميد وهو مركب راسمي، أي أنه، يحتوى على كل من المتزامر اليميني واليساري بكميات متساوية. أحد المتقابلات الضوئية فعال في علاج غثيان الصباح الذي يحدث للسيدات الحوامل، والمقابل الضوئي الأخر له تأثؤي مشوه للأجنة. ومن المهم ملاحظة أن المقابلات الضوئية تتحول لبعضها البعض في الكائنات الحية. أي أنه في حالة إعطاء جرعة للإنسان من دى- ثاليدوميد أو إل- ثاليدوميد، فكلا المقابلين يتواجدا في الدم. أي أن إعطاء مقابل واحد لن يمنع التأثير المشوه للعقار.
وعموما فإن، الجزيء اليدواني له «نقطة يدواني» التي تتمركز عند ذرة عدم التماثل (غالبا ذرة كربون). وهذه الحالة توجد في الأحماض الأمينية اليدواني حيث تكون ذرة الكربون الألفا هي مركز عدم التماثل، ولها نقطة يدواني. ويمكن للجزيء أن يكون به أكثر من مركز يدواني بدون أن يكون الجزيء يدواني ككل وذلك لو أن هناك عنصر تماثل (مستوى تماثل يقسم الجزيء لقسمين متساويين) يمكن أن يدور حوله مراكز اليدواني. وتسمى هذه المركبات بالميزو مركبات. كما انه أيضا من الممكن للجزيئات أن تكون يدواني بدون وجود مركز يدواني في الجزيء. الأمثلة لذلك تتضمن 1,1´-ثنائي-2-نافثول (1,1’-bi-2-naphthol BINOL), و1,3-ثنائي كلورو-أللين (1,3-dichloro-allene) ولهما سطح يدواني أو يدواني محوري.
ومعقد [Ru(2,2'-bipyridine)3]2+ مثل لدزيء يدواني به درجة عالية من التماثل. وينتمى إلى نقطة مجموعة D3. ويعنى أن له ثلاثة أضعاف محور دوران متماثل، وضعفين لثلاث محاور عمودية. وفي هذه الحالة، تكون ذرة Ru يمكن أن تعامل على أنها مركز عدم تماثل لأن المعقد له نقطة يدواني. ويجب التفريق بين التشاكل (conformation), التكوين (configuration) عند مناقشة اليدواني. التشاكل هو وضع مؤقت للذرات في الجزيء يمكن افتراضه نتيجة لدوران الروابط، أو انثنائها، أو شدها طالما أنه لم يحدث هناك كسر لهذه الروابط. التكوين هو بناء الجزيء والذي يفترض أنه غير انعكاسي تحت الظروف المحيطة. المقابلات الضوئية، والمتزامرات الأخرى النشيطة ضوئيا مثل المقبلات غير الضوئية، هي أمثلة للمتزامرات التكوينية.
اقرأ ايضاً
المصادر
- «الكيمياء الفراغية للمركبات التناسقية»
- Ernest L. Eliel and Samuel H. Wilen, 1994. «الكيمياء الفراغية للمركبات العضوية», Wiley-Interscience.
- Alex von Zelewsky, 1996. «الكيمياء الفراغية للمركبات التناسقية», Wiley.
المراجع
- الهيئة النووية السورية نسخة محفوظة 29 مايو 2017 على موقع واي باك مشين. [وصلة مكسورة]
- المعجم الطبي الموحد.
- كلية الصيدلة بجامعة حلب. [وصلة مكسورة] نسخة محفوظة 29 يوليو 2015 على موقع واي باك مشين.
- الهيئة النووية السورية نسخة محفوظة 30 يوليو 2017 على موقع واي باك مشين. [وصلة مكسورة]
- الهيئة الذرية السورية نسخة محفوظة 28 يناير 2007 على موقع واي باك مشين. [وصلة مكسورة]
- بوابة الكيمياء