أيض
الأيض أو الاستقلاب (بالإنجليزية: Metabolism) هو مجموعة من التفاعلات الكيميائية في خلايا الكائن تحافظ على الحياة. الأهداف الرئيسية الثلاث للأيض هي تحويل الغذاء/الوقود إلى طاقة لتشغيل العمليات الخلوية، وتحويل الغذاء/الوقود إلى وحدات بناء للبروتينات، والدهون، والأحماض النووية، وبعض السكريات، وإزالة الفضلات الأيضية النيتروجينية. تلك التفاعلات التي تحفزها إنزيمات تسمح للكائنات بالنمو والتكاثر، والمحافظة على تركيبها، والاستجابة للبيئة. يمكن أن يشير مصطلح الأيض كذلك إلى مجموع كل التفاعلات الكيميائية التي تحدث في الكائنات الحية، بما فيها الهضم ونقل المواد إلى وبين الخلايا المختلفة، وفي تلك الحالة تسمى التفاعلات داخل الخلايا أيض وسيط أو أيض متوسط.
| جزء من سلسلة حول |
| كيمياء حيوية |
|---|
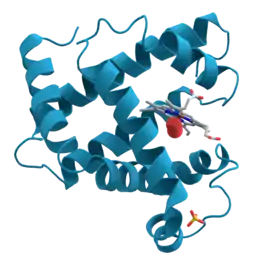 |
| المكونات الرئيسية |
|
| التاريخ والموضوعات |
|
|
| بوابات: كيمياء حيوية |
يتم تقسيم الأيض عادة إلى فئتين: التقويض، أي تكسير المواد العضوية، على سبيل المثال، تكسير الجلوكوز إلى حمض البيروفيك، عن طريق التنفس الخلوي، وابتناء، أي بناء مكونات الخلايا مثل البروتينات والأحماض النووية. عادة، يحرر التقويض طاقة فيما يستهلك الابتناء الطاقة.
يتم تنظيم تفاعلات الأيض الكيميائية في مسارات أيضية، يتم من خلالها تحويل مركب كيميائي لآخر عبر سلسلة من الخطوات بواسطة سلسلة من الإنزيمات. تعتبر الإنزيمات مصيرية بالنسبة للأيض لأنها تسمح للكائنات بتنفيذ تفاعلات مرغوب بها تحتاج للطاقة ولن تحدث بنفسها دون الإنزيمات، حيث تقوم الإنزيمات بدمجها بتفاعلات تلقائية تحرر طاقة. تعمل الإنزيمات كمحفزات تسمح بحدوث التفاعلات بشكل أسرع. تسمح الإنزيمات كذلك بتنظيم المسارات الأيضية استجابةً للتغيرات في بيئة الخلية أو لإشارات من خلايا أخرى.
يحدد النظام الأيضي لكائن معين أي المواد ستكون مغذية وأيها تكون سامة. على سبيل المثال، بعض بدائيات النوى تستخدم كبريتيد الهيدروجين كمغذي، إلا أن هذا الغار سام للحيوانات. تؤثر سرعة الأيض، ومعدل الأيض على كم الغذاء الذي سيحتاجه الكائن، وكذلك على قدرته على الحصول على ذلك الغذاء.
السمة اللافتة في عملية الأيض هي تشابه المسارات والمكونات الأيضية الأساسية بين الأنواع المختلفة إلى حد كبير. على سبيل المثال، مجموعة الأحماض الكربوكسيلية التي تشتهر بكونها مركبات وسيطة في دورة حمض الستريك تتواجد في كل الكائنات المعروفة، حيث وجدت في كائنات متباينة للغاية كبكتيريا إشريكية قولونية وحيدة الخلية والكائنات العملاقة متعددة الخلايا مثل الأفيال.
التسميات العربية
تختلف ترجمة المصطلح العلمي metabolism باختلاف الدول العربية حيث تستخدم تسمية أيض في مصر[1] وفلسطين[2] والأردن[3] والسعودية[4] والعراق[5] والإمارات[6] واليمن[7] وليبيا[8] والجزائر[9] والكويت.[10] فيما تستخدم تسمية استقلاب في سوريا.[11] كما تستخدم تسمية تمثيل غذائي في مصر أيضا.[12]
المواد الكيميائية الحيوية الرئيسية

معظم الهياكل التي تشكل الحيوانات، النباتات والميكروبات تتكون من ثلاث فئات أساسية من الجزيئات: حمض أميني، الكربوهيدرات والدهنيات (وتسمى في كثير من الأحيان الدهون). وهي مصدر الطاقة المختزنة في الجسم لاستخدامها وقت المجاعة أو أثناء الصوم. حيث أن هذه الجزيئات الحيوية للحياة، التفاعلات الأيضية إما تركز على جعل هذه الجزيئات أثناء بناء الخلايا والأنسجة، أو تقسيمها واستخدامها كمصدر للطاقة، وعن طريق الهضم. هذه المواد الكيميائية الحيوية يمكن أن تدمج معا لصنع مبلمرات مثل الحمض النووي الريبوزي المنقوص الأكسجين والبروتينات، الجزيئات الأساسية للحياة.
| نوع الجزيء | اسم الأشكال المونومرية | اسم الأشكال المبلمرية | أمثلة على الأشكال المبلمرية |
|---|---|---|---|
| حموض أمينية | حموض أمينية | بروتينات (تسمى أيضا عديدات الببتيد) | بروتينات ليفية وبروتينات كروية |
| كربوهيدرات | سكريات أحادية | سكريات متعددة | النشا، الغلايكوجين والسليلوز |
| حموض نووية | نيوكليوتيدات | عديدات النيوكليوتيد | حمض نووي ريبوزي منقوص الأكسجين وحمض نووي ريبوزي |
الأحماض الأمينية والبروتينات
تتكون البروتينات من أحماض أمينية مرتبة في سلسلة طولية ترتبط معا بروابط ببتيدية. العديد من البروتينات هي إنزيمات تحفز التفاعلات الكيميائية في الأيض. تمتلك البروتينات الأخرى وظائف هيكلية أو ميكانيكية، مثل البروتينات التي تشكل الهيكل الخلوي، وهو نظام من السقالة يحافظ على شكل الخلية. كذلك فإن البروتينات مهمة في تأشير الخلية، واستجابة المناعة، والتصاق الخلايا، والنقل النشط عبر الأغشية، ودورة الخلية. تساهم الأحماض الأمينية أيضا في أيض الطاقة الخلوي عن طريق توفير مصدر للكربون للدخول في دورة حمض الستريك، بالأخص حين يكون مصدر الطاقة الرئيسي، مثل الجلوكوز، نادرًا، أو حين تكون الخلايا تحت إجهاد أيضي.
الدهون
الدهون هي المجموعة الأكثر تنوعًا من المواد الكيماوية الحيوية. استخداماتها الهيكلية الرئيسية هي كونها جزء من الأغشية الحيوية سواء الداخلية أو الخارجية، مثل غشاء الخلية، أو كمصدر للطاقة. تُعرف الدهون عادة على أنها جزيئات حيوية كارهة للماء أو مزدوجة الألفة ولكن تذوب في المذيبات العضوية مثل البنزين أو كلوروفورم. الدهون هي مجموعة كبيرة من المركبات التي تحتوي على أحماض دهنية وغليسرول، جزئ غليسرول مرتبط بـ3 إسترات أحماض دهنية يسمى ثلاثي الغليسريد. تتواجد العديد من التنوعات على الهيكل الأساسي، بما في ذلك هياكل بديلة مثل سفينغوزين في الشحميات السفينجولية، ومجموعات محبة للماء مثل الفوسفات في الدهن الفسفوري. ستيرويدات مثل الكولسترول هي فئة أخرى كبيرة من الدهون.
السكريات
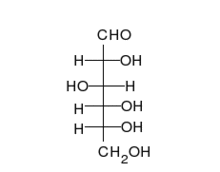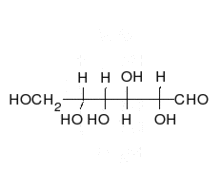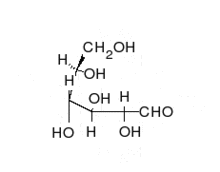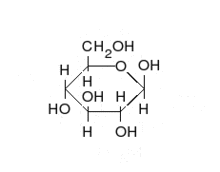
الكربوهيدرات هي ألدهيدات أو كيتونات، مع العديد من مجموعات الهيدروكسيل المرتبطة بها. يمكنها التواجد في صورة سلاسل مستقيمة أو حلقات. السكريات هي الجزيئات الحيوية الأكثر وفرة، وتؤدي العديد من الأدوار، مثل تخزين ونقل الطاقة (نشا، وغلايكوجين)، وكونها مكونات هيكلية (سليولوز في النبات، وكيتين في الحيوانات). تسمى وحدات السكريات الأساسية سكر أحادي وتشمل جالاكتوز، وفركتوز، والأهم الجلوكوز. يمكن أن ترتبط السكريات الأحادية معا لتكوين متعدد السكاريد.
النوكليوتيدات
الحمضان النوويان، حمض نووي ريبوزي منقوص الأكسجين (DNA) وحمض نووي ريبوزي (RNA) هما بوليمران للنوكليوتيدات. يتكون كل نوكليوتيد من مجموعة فوسفات ترتبط بسكر الريبوز أو ريبوز منقوص الأكسجين والذي يرتبط بقاعدة نيتروجينية. تعد الأحماض النووية هامة لتخزين واستعمال المعلومات الوراثية، وترجمتها عبر عمليات النسخ، والاصطناع الحيوي للبروتين. تتم حماية هذه المعلومات بواسطة آليات ترميم الدنا وتنتشر بواسطة تضاعف الحمض النووي الريبوزي منقوص الأكسجين. تمتلك العديد من الفيروسات جينوم من الحمض النووي الريبوزي، مثل فيروس العوز المناعي البشري، الذي يستخدم الانتساخ العكسي لصنع نموذج DNA من جينوم الـRNA.[13] الـRNA في إنزيمات الحمض النووي الريبوزي مثل جسيمات التضفير والريبوسومات تشبه الإنزيمات في قدرتها على تحفيز التفاعلات الكيميائية. يتم تكوين النيوكليوسيدات عن طريق ارتباط قاعدة نووية بسكر ريبوز. تلك القواعد هي عبارة عن مركبات حلقية غير متجانسة تحتوي على النيتروجين، وتصنف إما بيورينات أو بيريميدينات. تعمل النوكليوتيدات كعوامل مرافقة في تفاعلات الأيض.[14]
العوامل المرافقة
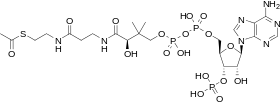
يتضمن الأيض مجموعة شاسعة من التفاعلات الكيميائية، لكن أغلبها يقع تحت أنواع أساسية قليلة من التفاعلات التي تتضمن انتقال مجموعات وظيفية من الذرات وروابطها بين الجزيئات.[15] تسمح الكيمياء المشتركة للخلايا باستخدام مجموعة صغيرة من الوسائط الأيضية لحمل المجموعات الكيميائية بين التفاعلات المختلفة. تلك الوسائط الناقلة للمجموعات تسمى عوامل مرافقة. يتم تنفيذ كل فئة من التفاعلات الناقلة للمجموعات بواسطة عامل مرافق معين، وهو ركيزة لمجموعة من الإنزيمات التي تنتجه، ومجموعة من الإنزيمات التي تستهلكه. لذلك يتم تصنيع واستهلاك وإعادة تدوير تلك العوامل المرافقة باستمرار.[16]
عامل مرافق مركزي هو أدينوسين ثلاثي الفوسفات (ATP)، العملة الموحدة للطاقة في الخلايا. يستخدم هذا النوكليوتيد لتقل الطاقة الكيميائية بين التفاعلات الكيميائية المختلفة. توجد كمية قليلة من ATP في الخلايا، ولكن تتم إعادة توليده باستمرار، يمكن أن يستخدم الجسم البشري وزنه من الـATP في اليوم. يعمل أدينوسين ثلاثي الفوسفات كجسر بين التقويض والابتناء. يقوم التقويض بتكسير الجزيئات، ويضعهم الابتناء معًا. تولد تفاعلات التقويض ATP، فيما تستهلكه تفاعلات الابتناء. كما يعمل أيضا كحامل لمجموعات الفوسفات في تفاعلات الفسفرة.
الفيتامين هو مركب عضوي يحتاجه الجسم بكميات صغيرة ولا يمكن تصنيعه في الخلايا. في تغذية الإنسان، تعمل أغلب الفيتامنيات كعوامل مرافقة بعد التعديل، على سبيل المثال، كل الفيتامينات التي تذوب في الماء تنم فسفرتها أو ترتبط بالنوكليوتيدات حين يتم استخدامها في الخلايا.[17]ثنائي نوكليوتيد الأدنين وأميد النيكوتين (NAD+)، أحد مشتقات فيتامين ب3 (نياسين)، يعد عامل مرافق مهم يعمل كمستقبل للهيدروجين. تقوم مئات الأنواع المنفصلة من الإنزيمات نازعة الهيدروجين بنزع الإلكترونات من ركائزها وتختزل NAD+ إلى NADH. تلك الصورة المختزلة من العامل المرافق تصبح ركيزة للعديد من الإنزيمات المختزلة في الخلية.[18] يتواجد ثنائي نوكليوتيد الأدنين وأميد النيكوتين في شكلين مرتبطين في الخلية، NADH وNADPH. الشكل الأول NAD+/NADH هو أكثر أهمية في تفاعلات التقويض، بينما يستخدم NADP+/NADPH في تفاعلات الابتناء.

المعادن والعوامل المرافقة
تلعب العناصر غير العضوية أدوارًا هامة في الأيض، بعضها وفير (مثل الصوديوم، والبوتاسيوم) فيما يؤدي البعض الآخر وظائفه في تركيزات دقيقة. تتكون حوالي 99% من كتلة الثدييات من العناصر التالية: كربون، ونيتروجين، وكالسيوم، وكلور، وبوتاسيوم، وهيدروجين، وفوسفور، وأكسجين، وكبريت.[19] تحتوي المركبات العضوية (البروتينات، والدهون، والسكريات) على أغلب الكربون والنيتروجين، يتواجد أغلب الأكسجين والهيدروجين في صورة ماء.
تعمل العناصر غير العضوية الوفيرة ككهارل أيونية. الأيونات الأكثر أهمية هي الصوديوم، والبوتاسيوم، والكالسيوم، والماغنسيوم، والكلور، والفوسفات، والأيون العضوي بيكربونات. المحافظة على تدرج أيوني دقيق عبر الأغشية الخلوية يحافظ على الضغط الإسموزي والأس الهيدروجيني.[20] الأيونات مهمة كذلك لوظيفة الأعصاب والعضلات، حيث يتم إنتاج جهد الفعل في تلك الأنسجة بواسطة تبادل الكهارل بين السائل خارج خلوي وسائل الخلية (عصارة خلوية).[21] تدخل الكهارل الخلايا وتغادرها عبر بروتينات في غشاء الخلية تسمى قنوات أيونية. على سبيل المثال، يعتمد الانقباض العضلي على حركة الكالسيوم، والصوديوم، والبوتاسيوم عبر القنوات الأيونية في غشاء الخلية والأنيبيبات المستعرضة.[22]
توجد الفلزات الانتقالية عادة في صورة عناصر شحيحة في الكائنات، ويعد الحديد والزنك الأكثر وفرة.[23][24] تستخدم تلك الفلزات في بعض البروتينات كعوامل مرافقة وهي ضرورية لنشاط إنزيمات مثل كاتالاز والبروتينات الحاملة للأكسجين مثل الهيموغلوبين.[25]
التفاعلات
تنقسم تفاعلات الاستقلاب إلى:
1- تفاعلات الهدم Catabolism: حيث يتم تكسير المواد الغذائية الرئيسية سواء كانت كربوهيدرات أو بروتينات أو دهون خلال طرق مختلفة من التفاعلات الحيوية إلى جزيئات بسيطة وينتج عن ذلك الحصول على الطاقة.
2-تفاعلات البناء (Anabolism): الجزيئات البسيطة الناتجة من عملية الهدم يمكن استخدامها كنواة لبناء مواد أكثر تعقيداً سواء كانت بروتينية أو أحماض نووية من خلال سلسلة من التفاعلات وذلك لبناء الأنسجة وتستهلك طاقة في تلك التفاعلات.
تأخذ عمليات البناء والهدم مسارات مختلفة من ناحية التفاعلات الحيوية داخل جسم الكائن الحي، يتم فيها تحويل المواد الكيميائية عن طريق سلسلة من الأنزيمات.هذه الأنزيمات هي حاسمة لعملية التمثيل الغذائي حيث تعمل على تسريع التفاعلات وتكون مهمة جداً في الحفاظ على حياة الخلية.
أحد السمات البارزة في عملية الأيض هو التشابه في المسارات الأساسية بين كائنات تختلف اختلافاً شاسعاً عن بعضها البعض.
معظم الهياكل التي تشكل الحيوانات والنباتات والميكروبات مصنوعة من ثلاث فئات أساسية من الجزيئات: الأحماض الأمينية، الكربوهيدرات، والدهون. ووظيفة التمثيل الغذائي تتركز في استخدام هذه الجزيئات في بناء الخلايا والأنسجة، أو تقسيمها واستخدامها كمصدر للطاقة. ويمكن أن تجتمع هذه المواد الكيميائية لتشكل بوليمرات مثل الحمض النووي والبروتينات.
ويبدأ استقلاب الكربوهيدرات مع امتصاص الغلوكوز عبر جدران الأمعاء إلى الدم فيحمل البعض منه إلى مختلف أنحاء الجسم حيث يتم استقلابه في حين يتم تخزين البعض الآخر في الكبد والعضلات على شكل سكر أو غلايكوجين وتتفكك بعد ذلك عند الحاجة.
التقويض
التقويض هو مجموعة من العمليات الأيضية التي تقوم بتكسير الجزيئات الكبيرة. تشمل تلك التفاعلات تكسير وأكسدة جزيئات الطعام. الهدف من تفاعلات التقويض هو توفير الطاقة والمكونات المطلوبة في تفاعلات الابتناء التي تبني الجزيئات. تختلف طبيعة تلك التفاعلات من كائن لآخر، ويمكن تقسيم الكائنات وفقًا لمصادر الطاقة والكربون الخاصة بهم (مجموعات غذائية أساسية)، كما يتضح في الجدول بالأسفل. تستخدم الجزيئات العضوية كمصدر للطاقة بواسطة الكائنات عضوية التغذية، فيما تستخدم الكائنات جمادية التغذية ركائز غير عضوية، وتستخدم الكائنات ضوئية التغذية ضوء الشمس كطاقة كيميائية. على أي حال، تعتمد كل تلك الأشكال المختلفة من الأيض على تفاعلات أكسدة-اختزال تتضمن انتقال إلكترونات من متبرع مختزَل مثل المركبات العضوية، أو الماء، أو الأمونياك، أو كبريتيد الهيدروجين، أو حديدوز إلى جزيئات مستقبلة مثل الأكسجين، أو النترات، أو الكبريتات.[26] في الحيوانات، تتضمن تلك التفاعلات مركبات عضوية معقدة يتم تكسيرها إلى جزيئات أبسط، مثل ثنائي أكسيد الكربون والماء. في كائنات البناء الضوئي، مثل النباتات والبكتيريا الزرقاء، لا تُطلق تلك التفاعلات الناقلة للإلكترونات طاقة وإنما تستعمل كطريقة لتخزين الطاقة الممتصة من ضوء الشمس.[27]
| مصدر الطاقة | ضوء الشمس | ضوئية- | -التغذية |
| الجزيئات المشكلة سابقا | كيميائية- | ||
| المتبرع بالإلكترون | مركبات عضوية | عضوية- | |
| مركبات لاعضوية | جمادية- | ||
| مصدر الكربون | مركبات عضوية | غيري- | |
| مركبات لاعضوية | ذاتية- |
يمكن فصل المجموعة الأكثر شيوعًا من تفاعلات التقويض في الحيوانات إلى 3 مراحل رئيسية. في المرحلة الأولى، يتم هضم مركبات عضوية كبيرة، مثل البروتينات، أو متعددات السكاريد، أو الدهون إلى مكوناتهم الأصغر خارج الخلايا. المرحلة التالية، يتم استيعاب تلك الجزيئات الأصغر بواسطة الخلايا وتحويلها لجزيئات أصغر، عادة أسيتيل مرافق الإنزيم-أ، الذي يطلق بعض الطاقة. أخيرا، مجموعة الأسيتيل الموجودة في أسيتيل مرافق الإنزيم-أ يتم أكسدتها إلى ماء وثنائي أكسيد الكربون في دورة حمض الستريك وسلسلة نقل الإلكترون، ما يحرر طاقة يتم تخزينها عن طريق اختزال العامل المرافق ثنائي نوكليوتيد الأدنين وأميد النيكوتين (NAD+) إلى NADH.
الهضم
الجزيئات الضخمة مثل النشا، أو السليولوز، أو البروتينات لا يمكن استيعابها بسرعة بواسطة الخلايا ويجب تكسيرها لوحدات أصغر قبل استخدامها في أيض الخلية. العديد من فئنات الإنزيمات المشتركة تهضم تلك البوليمرات. تلك الإنزيمات الهضمية تشمل ببتيداز الذي يهضم البروتينات إلى أحماض أمينية، بالإضافة إلى هيدروليزات الغلايكوسيد التي تهضم متعددات السكاريد إلى سكريات بسيطة تعرف باسم سكر أحادي.
تفرز الميكروبات ببساطة إنزيمات هضمية إلى البيئة المحيطة بها،[28][29] بينما تستطيع الحيوانات إفراز تلك الإنزيمات فقط من خلايا متخصصة في قناتها الهضمية التي تشمل الغدد اللعابية، والمعدة، والبنكرياس.[30] الأحماض الأمينية، أو السكريات الناتجة عن تلك الإنزيمات يتم ضخها لداخل الخلايا بواسطة بروتينات النقل النشط.[31][32]
الطاقة من المركبات العضوية

تقويض السكريات هو تكسير السكريات إلى وحدات أصغر. عادة ما يتم استيعاب السكريات لداخل الخلايا بمجرد أن يتم هضمها إلى سكريات أحادية.[33] بمجرد دخولها، الطريقة الأكبر للتحلل هي تحلل الجلوكوز، والتي يتم فيها تحويل سكريات مثل الجلوكوز والفركتوز إلى حمض البيروفيك مع توليد بعض جزيئات أدينوسين ثلاثي الفوسفات (ATP).[34] حمض البيروفيك هو مركب وسيط في العديد من المسارات الأيضية، لكن أغلبه يتم تحويله إلى أسيتيل مرافق الإنزيم-أ عن طريق تحلل الجلوكوز الهوائي ويتم تقديمه لدورة حمض السيتريك. رغم أنه يتم توليد المزيد من ATP في دورة حمض الستريك، فإن المنتج الأهم هو NADH الذي يتم تصنيعه من NAD+ عند أكسدة أسيتيل مرافق الإنزيم-أ. تحرر الأكسدة ثنائي أكسيد الكربون كمخلف للتفاعل. في الظروف اللاهوائية، يُنتج تحلل الجلوكوز حمض اللبنيك، عن طريق قيام إنزيم نازع لهيدروجين اللاكتات بإعادة أكسدة NADH إلى NAD+ ليتم استخدامه مجددا في تحلل الجلوكوز. طريق بديل لتكسير الجلوكوز هو مسار فوسفات البنتوز، الذي يختزل العامل المرافق فوسفات ثنائي نيوكليوتيد الأدينين وأميد النيكوتين NADPH وينتج سكريات خماسية مثل الريبوز.
يتم تقويض الدهون عن طريق التحلل المائي إلى أحماض دهنية حرة وغليسرول. يدخل الغليسرول في مسار تحلل الجلوكوز بينما يتم تكسير الأحماض الدهنية بواسطة أكسدة الحمض الدهني لتحرير أسيتيل مرافق الإنزيم-أ، الذي يتم تقديمه لدورة حمض الستريك. تطلق الأحماض الدهنية طاقة أكبر من السكريات عند أكسدتها لأن السكريات تحتوي على أكسجين أكثر في تركيبها. يتم تحليل الستيرويدات أيضا في بعض البكتيريا في عملية مشابهة لأكسدة الحمض الدهني، وتشمل عملية التحلل تلك إطلاق كميات كبيرة من أسيتيل مرافق الإنزيم-أ، وبروبيونيل مرافق الإنزيم-أ، وحمض البيروفيك، والذين يمكن استخدامهم جميعا بواسطة الخلية كمصدر للطاقة. بكتيريا المتفطرة السلية يمكنها أن تنمو اعتمادا على الكولسترول كمصدر وحيد للكربون، وتم التحقق من صحة أن الجينات المشاركة في مسارات استهلاك الكولسترول مهمة خلال مراحل متنوعة من دورة حياة العدوى لبكتيريا المتفطرة السلية.[35]
يتم استخدام الأحماض الأمينية إما لتصنيع البروتينات والجزيئات الحيوية الأخرى، وإما كمصدر للطاقة عن طريق أكسدتها إلى يوريا وثنائي أكسيد الكربون.[36] يبدأ مسار الأكسدة بنزع مجموعة الأمين عن طريق ناقلة الأمين. يتم تقديم مجموعة الأمين لدورة اليوريا، ما يترك هيكل كربوني منزوع الكربون في صورة حمض كيتو. العديد من أحماض الكيتو تلك تعد مركبات وسيطة في دورة حمض الستريك، على سبيل المثال نزع الأمين من حمض الجلوتاميك يكوِّن حمض ألفا كيتوجلوتاريك.[37] يمكن كذلك تحويل الأحماض الأمينية المنتجة للجلوكوز إلى جلوكوز، من خلال استحداث الجلوكوز.[38]
تحويل الطاقة
فسفرة تأكسدية
في الفسفرة التأكسدية، يتم إزالة الإلكترونات من الجزيئات العضوية في مناطق مثل دورة حمض البروتاغون ويتم تحويلها لأكسجين وتستخدم الطاقة المتحررة في تصنيع أدينوسين ثلاثي الفوسفات (ATP). يتم ذلك في حقيقيات النوى بواسطة سلسلة من البروتينات في أغشية الميتوكوندريا تعرف باسم سلسلة نقل الإلكترون. في بدائيات النوى، توجد تلك البروتينات في الغشاء الداخلي للخلية.[39] تستخدم تلك البروتينات الطاقة المتحررة من الالكترونات المارة عبر الجزيئات المختزلة مثل NADH لضخ البروتونات عبر الغشاء.[40]

ضخ البروتونات خارج الميتوكندريا يخلق فرق في تركيز البروتون عبر الغشاء ويولد تدرج كهروكيميائي.[41] تقود هذه القوة البروتونات مرة أخرى لداخل الميتوكندريا عن طريق قاعدة إنزيم يسمى أيه تي بي سينثاز. يجعل تدفق البروتونات الوحدة الدوارة تدور، ما يغير من شكل الموقع النشط في الإنزيم ويقوم بفسفرة ADP محولا إياه إلى ATP.
طاقة من المركبات غير العضوية
جمادي التغذية الكيميائي هو نوع من الأيض يوجد في بدائيات النوى حيث يتم الحصول على الطاقة من أكسدة المركبات غير العضوية. يمكن لتلك المتعضيات استخدام الهيدروجين،[42] أو مركبات الكبريت المختزلة (مثل الكبريتيد، وكبريتيد الهيدروجين، وثيوكبريتات)، أوأكسيد الحديد الثنائي،[43] أو الأمونيا كمصادر لاختزال الطاقة ويحصلون على الطاقة عن طريق أكسدة تلك المركبات بواسطة قابلات الإلكترونات مثل الأكسجين أو النتريت.[44] تلك العمليات الميكروبية مهمة في الدورات الحيوية الجيولوجية الكيميائية العامة مثل تكوين الأسيتون، والنترجة، ونزع النيتروجين وهي عمليات مهمة لخصوبة التربة.[45][46]
طاقة من الضوء
تنتزع النباتات، والبكتيريا الزرقاء، والبكتيريا الأرجوانية، والخضربيات وبعض الطلائعيات الطاقة من ضوء الشمس. ترتبط هذه العملية عادة بتحويل ثنائي أكسيد الكربون إلى مركبات عضوية، كجزء من البناء الضوئي. يمكن مع ذلك أن تتم العمليتان بشكل منفصل كما في بدائيات النوى، كما يمكن للبكتيريا الأرجوانية، والخضربيات استخدام ضوء الشمس كمصدر للطاقة مع التنقل بين تثبيت الكربون أو تخمير المواد العضوية.[47][48]
في العديد من المتعضيات يشبه انتزاع الطاقة الشمسية في المبدأ الفسفرة التأكسدية، حيث يشمل تخزين الطاقة في صورة فرق تركيز لبروتون. ذلك الفرق في التركيز هو الذي يؤدي لتصنع ATP. تأتي الإلكترونات المطلوبة لسلسة نقل الإلكترون من بروتينات جامعة للضوء تسمى رودوبسين أو مراكز رد فعل البناء الضوئي. يتم تقسيم مراكز رد الفعل إلى نوعين على حسب نوع صبغة البناء الضوئي الموجودة، تملك أغلب البكتيريا البانية للضوء نوع واحد، فيما تملك النباتات والبكتيريا الزرقاء نوعين.[49]
في النباتات، والطحالب، والبكتيريا الزرقاء، تستخدم وحدات النظام الثاني للبناء الضوئي الطاقة الضوئية لإزالة الإلكترونات من الماء، وتحرير الأكسجين كمخلف للتفاعل. تتدفق الإلكترونات بعد ذلك إلى سيتوكروم b6f complex، الذي يستخدم طاقتهم لضخ البروتونات عبر غشاء الثايلاكويد في البلاستيدات الخضراء. تنتقل تلك البروتونات مرة أخرى عبر الغشاء حيث تدفع أيه تي بي سينثاز -كما سبق-. تتدفق الإلكترونات بعد ذلك عبر وحدات النظام الأول للبناء الضوئي ويمكنها بعد ذلك إما أن تختزل تميم الإنزيم NADP+، لاستخدامه في دورة كالفين، أو أن يعاد تدويرها لتوليد المزيد من ATP.[50]
الابتناء
الابتناء هو مجموعة من العمليات الأيضية البناءة يتم فيها استخدام الطاقة المتحررة من التقويض لتصنيع جزيئات معقدة. عمومًا، يتم تصنيع الجزئيات المعقدة التي تكون التركيب الخلوي خطوة بخطوة من مركبات طليعية صغيرة وبسيطة. يشمل الابتناء 3 مراحل أساسية. أولا، إنتاج المركبات الطيلعية مثل الأحماض الأمينية، والسكر الأحادي، وتربينويد، ونوكليوتيدات، وثانيا، تنشيطهم إلى صور متفاعلة باستخدام الطاقة من أدينوسين ثلاثي الفوسفات، وثالثا، تجميع تلك المركبات الطليعية لتكوين جزيئات معقدة مثل البروتينات، ومتعددات السكاريد، والدهون، والأحماض النووية.
تختلف الكائنات من حيث عدد الجزيئات التي يتم بناؤها في خلاياها. الكائنات ذاتية التغذية مثل النباتات يمكنها بناء الجزيئات العضوية المعقدة في الخلايا مثل متعددات السكاريد والبروتينات من جزيئات بسيطة مثل ثنائي أكسيد الكربون والماء. الكائنات غيرية التغذية في المقابل، تحتاج لمصدر للمواد الأكثر تعقيدا، مثل السكريات الأحادية والأحماض الأمينية، لإنتاج تلك الجزيئات المعقدة. يمكن تصنيف الكائنات بحسب المصدر النهائي للطاقة: تحصل الكائنات ضوئية التغذية، والكائنات الضوئية غيرية التغذية على الطاقة من الضوء، بينما تحصل الكائنات كيميائية التغذية، والكائنات كيميائية غيرية التغذية على الطاقة من تفاعلات أكسدة غير عضوية
تثبيت الكربون

البناء الضوئي هو تصنيع الكربوهيدرات من ضوء الشمس وثنائي أكسيد الكربون. في النبات، والبكتيريا الزرقاء، والطحالب، البناء الضوئي الأكسجيني يقسم الماء، وينتج الأكسجين كمخلفات للتفاعل. تستخدم هذه العملية أدينوسين ثلاثي الفوسفات (ATP) وثنائي نوكليوتيد الأدنين وأميد النيكوتين (NADPH) الناتجان عن مراكز رد فعل البناء الضوئي لتحويل ثنائي أكسيد الكربون إلى حمض 3-فوسفوغليسيريك، الذي يمكن تحويله بعد ذلك إلى جلوكوز. يتم تنفيذ تفاعل تثبيت الكربون بواسطة إنزيم روبيسكو كجزء من دورة كالفين.[51] يحدث 3 أنواع من البناء الضوئي في النباتات: تمثيل ضوئي ثلاثي الكربون، وتمثيل ضوئي رباعي الكربون، وأيض حامض المخلدات. الفرق بين أولئك هو الطريق الذي يسلكه ثنائي أكسيد الكربون نحو دورة كالفين، ففي ثلاثي الكربون يقوم النبات بتثبيت ثنائي أكسيد الكربون مباشرة، أما في النوعين الآخرين يدمج البناء الضوئي ثنائي أكسيد الكربون في المركبات الأخرى أولا، كطريقة للتكيف مع ضوء الشمس القوي والظروف الجافة.[52]
في بدائيات النوى التي تقوم بالبناء الضوئي، آليات تثبيت الكربون أكثر تنوعا. حيث يمكن تثبيت ثنائي أكسيد الكربون بواسطة دورة كالفين، وهي دورة حمض الستريك ولكن معكوسة،[53] أو عن طريق إضافة كربوكسيل لأسيتيل مرافق الإنزيم-أ.[54][55] بدائيات النوى كيميائية التغذية تثبت ثنائي أكسيد الكربون عبر دورة كالفين، ولكنها تستخدم الطاقة الصادرة من المركبات غير العضوية لتحفيز التفاعل.[56]
السكريات والغليكانات
في ابتناء السكريات، يمكن تحويل الأحماض العضوية البسيطة إلى سكريات أحادية مثل الجلوكوز ثم تجميعها لتكوين متعددات السكاريد مثل النشا. توليد الجلوكوز من مركبات مثل حمض البيروفيك، وحمض اللبنيك، وغليسرول، وحمض 3-فوسفوغليسيريك، والأحماض الأمينية يسمى استحداث الجلوكوز. يحول استحداث الجلوكوز حمض البيروفيك إلى جلوكوز 6-فوسفات عبر سلسلة من المركبات الوسطية، تشترك العديد منها في تحلل الجلوكوز. على أي حال، هذا المسار ليس مجرد تحلل الجلوكوز بشكل معكوس، حيث أن العديد من الخطوات يتم تحفيزها بإنزيمات غير موجودة في تحلل الجلوكوز. هذا الأمر مهم حيث يسمح بتنظيم تكوين وتكسير الجلوكوز بشكل منفصل، ويمنع حدوث المسارين بالتزامن في حلقة مفرغة.[57][58]
رغم أن الدهون هي طريقة شائعة لتخزين الطاقة، في الفقاريات مثل الإنسان لا يمكن تحويل الأحماض الدهنية في تلك المخازن إلى جلوكوز من خلال استحداث الجلوكوز حيث أن تلك الكائنات لا يمكنها تحويل أسيتيل مرافق الإنزيم-أ إلى حمض البيروفيك، تمتلك النباتات الإنزيمات الضرورية لذلك بينما لا تمتلكها الحيوانات.[59] نتيجة لذلك، بعد فترة طويلة من المجاعة، تحتاج الفقاريات لإنتاج أجسام كيتونية من الأحماض الدهنية لاستبدال الجلوكوز في الأنسجة مثل المخ الذي لا يستطيع أيض الأحماض الدهنية.[60] في الكائنات الأخرى كالنباتات والبكتيريا، يتم حل تلك المشكلة الأيضية باستخدام دورة الجلايكسولات، التي تتجاوز خطوة نزع الكربوكسيل الموجودة في دورة حمض الستريك وتسمح بتحول أسيتيل مرافق الإنزيم-أ إلى حمض أكسالوأسيتيك، الذي يمكن استخدامه لإنتاج الجلوكوز.[59][61]
يتم تصنيع متعددات السكاريد والغليكانات عن طريق إضافة متتابعة للسكريات الأحادية بواسطة إنزيم ناقل الغليكوزيل من سكر-فوسفات تفاعلي متبرع مثل غلوكوز ثنائي فوسفات اليوريدين إلى مجموعة هيدروكسيل مستقبلة على متعدد السكاريد النامي. نظرًا لأن أي من مجموعات الهيدروكسيل على حلقة المادة المتفاعلة يمكن أن تكون مستقبلة، يمكن أن يكون متعدد السكاريد الناتج إما متفرع أو مستقيم.[62] يمكن أن تمتلك متعددات السكاريد الناتجة وظائف تركيبية أو أيضية، أو يتم تحويلها إلى دهون أو بروتينات.[63][64]
الأحماض الدهنية، وتربينويد، وستيرويدات
يتم تصنيع الأحماض الدهنية بواسطة إنزيم مصنع الحمض الدهني الذي يبلمر ثم يختزل وحدات أسيتيل مرافق الإنزيم-أ. حلقات الأسيل الموجودة في الأحماض الدهنية تتمدد بواسطة حلقة من التفاعلات التي تضيف مجموعة الأسيل، وتختزلها إلى كحول، ثم تنزع منها الماء لتحولها إلى مجموعة ألكين ثم تختزلها مجددا إلى مجموعة ألكان. تنقسم إنزيمات التصنيع الحيوي للأحماض الدهنية إلى مجموعتين: في الحيوانات والفطريات، يتم تنفيد كل تفاعلات تصنيع الحمض الدهني بواسطة بروتين واحد متعدد الوظائف،[65] أما في بلاستيدات النبات وفي البكتيريا يؤدي إنزيم مختلف كل خطوة في المسار.[66][67]
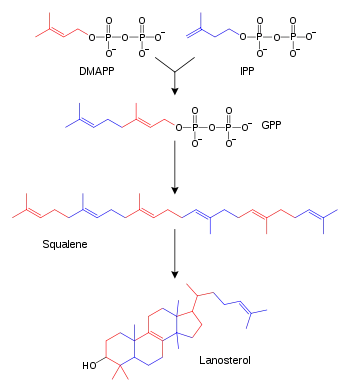
تربين، وتربينويد هما فئة كبيرة من الدهون التي تشمل كاروتينات وتشكل الفئة الأكبر من المنتجات الطبيعية للنبات.[68] يتم تصنيع تلك المركبات عن طريق تجميع وتعديل وحدات إيزوبرين التي تتبرع بها مركبات طليعية متفاعلة.[69] تفاعل مهم يستخدم المركبات المتبرعة بإيزوبرين هو تصنيع الستيرويد. حيث تنضم وحدات إيزوبرين لبعضها لبعض لتكوين سكوالين ثم يتم طيها لتشكيل مجموعة من الحلقات لتكون لانوستيرول.[70] يمكن بعد ذلك تحويل لانوستيرول ‘لى ستيرويدات أخرى مثل كولسترول وإرغوستيرول.[71]
البروتينات
تختلف الكائنات في قدرتها على تصنيع الـ20 حمض أميني المشتركة. تستطيع أغلب البكتيريا والنباتات تصنيع العشرين حمض جميعهم، إلا أن الثدييات تستطيع تصنيع 11 حمض أميني غير ضروري، لذلك فإن 9 أحماض أمينية ضرورية يجب الحصول عليها من الغذاء. بعض الطفيليات البسيطة، مثل بكتيريا المفطورة الرئوية، تفتقد القدرة على تصنيع أي من الأحماض الأمينية وتحصل على أحماضها الأمينية مباشرة من العائل.[72] يتم تصنيع كل الأحماض الأمينية من مركبات وسطية في تحلل الجلوكوز، ودورة حمض الستريك، أو مسار فوسفات البنتوز. يتم توفير النيتروجين بواسطة حمض الجلوتاميك والجلوتامين. يعتمد تصنيع الأحماض الأمينية على تكوين حمض كيتو ألفا المناسب، الذي يتم نقل مجموعة الأمين له لتكوين حمض أميني.[73]
يتم تصنيع البروتينات من الأحماض الأمينية عن طريق ضم بعضها لبعض في سلسلة من الروابط الببتيدية. يملك كل بروتين مختلف تسلسل فريد من الأحماض الأمينية: وهذا هو تركيبه الأولي. تماما كما يمكن دمج حروف الأبجدية لتكوين عدد لا نهائي من الكلمات، يمكن ربط الأحماض الأمينية في تسلسلات مختلفة لتكوين عدد هائل من البروتينات. يتم تصنيع البروتينات من الأحماض الأمينية التي تم تنشيطها عن طريق الارتباط بجزئ حمض نووي ريبوزي ناقل برابطة إستر. يتم إنتاج هذا المركب الطليعي في تفاعل يعتمد على أدينوسين ثلاثي الفوسفات.[74] يعد هذا المركب ركيزة للريبوسوم، الذي ينضم إلى الحمض الأميني على سلسلة البروتين المطوي ، باستخدام معلومات التسلسل في الحمض النووي الريبوزي الرسول.[75]
تصنيع وإنقاذ النوكليوتيد
تتكون النوكليوتيدات من أحماض أمينية، وثنائي أكسيد الكربون، وحمض الفورميك في مسارات تتطلب كميات كبيرة من الطاقة الأيضية.[76] بناء على ذلك، تمتلك أغلب الكائنات أنظمة فعالة لإنقاذ النوكليوتيدات المتكونة.[77] يتم تصنيع البيورين كنيوكليوسيد (قواعد مرتبطة بالريبوز).[78] كل من الأدينين، والغوانين يتم تصنيعهما من مركب نيوكلوسيد طليعي إينوسين أحادي الفوسفات، الذي يتم تصنيعه باستخدام ذرات من الأحماض الأمينية جلايسين، وجلوتامين، وحمض الأسبارتيك. في المقابل، يتم تصنيع بيريميدين من أوروتيت، الذي يتم تصنيعه من جلوتامين وحمض الأسبارتيك.[79]
الدخيل الحيوي وأيض الأكسدة والاختزال
تتعرض كل الكائنات الحية باستمرار إلى مركبات لا يمكنهم استخدامها كغذاء وتكون ضارة إذا تراكمت في الخلايا، حيث لا توجد وظيفة أيضية له. تلك المركبات التي يحتمل أن تكون ضارة تسمى الغريب الحيوي أو الدخيل الحيوي.[80] الدخائل الحيوي مثل الأدوية المصنعة، والسموم الطبيعية، والمضادات الحيوية يتم إزالة سميتها بمجموعة من الإنزيمات الأيضية للغريب الحيوي. في الإنسان، تشمل تلك الإنزيمات مؤكسدات سيتوكروم بي450،[81] وغلوكويورنوسايل ترانسفيراز،[82] وجلوتاثيون أس-ترانسفيراز.[83] يعمل هذا الجهاز من الإنزيمات في 3 مراحل لأكسدة الغريب الحيوي أولاً (المرحلة 1) ثم ربط مجموعات قابلة للذوبان في الماء للجزئ (المرحلة 2). الغريب الحيوي المعدل القابل للذوبان في الماء يمكن بعد ذلك ضخة خارج الخلايا وفي الكائنات متعددة الخلايا يمكن أيضه أكثر من ذلك قبل إخراجه (المرحلة 3). في علم البيئة، تلك التفاعلات مهمة بالأخص في التحلل الحيوي الميكروبي للملوثات والمعالجة الحيوية للأرض الملوثة وتسرب النفط.[84] العديد من تلك التفاعلات الميكروبية تتواجد في كائنات متعددة الخلايا، ولكن بسبب التنوع الكبير في أنواع الميكروبات فإن تلك الكائنات قدرة على التعامل مع نطاق أوسع بكثير من الدخائل الحيوية مقارنة بالكائنات متعددة الخلايا، ويمكنها حتى تحليل الملوثات العضوية الثابتة مثل مركبات الكلوريد العضوي.[85]
مشكلة متعلقةبالكائنات الهوائية هي الإجهاد التأكسدي.[86] هنا، العمليات التي تشملفسفرة تأكسدية وتكوين روابط ثنائية الكبريتيد خلال تطوي البروتين تنتج أنواع الأكسجين التفاعلية مثل بيروكسيد الهيدروجين.[87] تلك المؤكسدات الضارة تتم إزالتها بواسطة مستقلبات مضادة للتأكسد مثل جلوتاثيون وإنزيمات مثل كاتالاز وبيروكسيداز.[88][89]
الديناميكا الحرارية للكائنات الحية
يجب أن تخضع الكائنات الحية لقوانين الديناميكا الحرارية، التي تصف انتقال الحرارة والشغل. ينص قانون الديناميكا الحراري الثاني على أنه في أي نظام مغلق، لا يمكن أن تقل كمية الإنتروبيا. رغم أن التعقيد المدهش للكائنات الحية يبدو أنه يتعارض مع هذا القانون، فإن الحياة ممكنة لأن جميع الكائنات تعد نظام مفتوح يتبادل المادة والطاقة مع الأشياء المحيطة به. بالتالي فإن الأنظمة الحية ليست في حالة توازن ترموديناميكي، وإنما هي أنظمة مبددة تحافظ على حالة التعقيد الكبير بالتسبب في زيادة أكبر في الإنتروبيا في بيئاتها.[90] يحقق أيض الخلية ذلك من خلال الربط بين العمليات التلقائية للتقويض والعمليات غير التلقائية للابتناء. بمصطلحات الديناميكا الحرارية، يحافظ الأيض على النظام عن طريق خلق الفوضى.[91]
التنظيم والتحكم
نظرًا لأن بيئة أغلب الكائنات تتغير باستمرار، يجب أن يتم تنظيم تفاعلات الأيض بشكل دقيق للحفاظ على مجموعة ثابتة من الظروف داخل الخلايا، فيما يعرف باسم الاستتباب.[92][93] يسمح تنظيم الأيض كذلك للكائنات الحية بالاستجابة للإشارات والتفاعل بشكل نشط مع بيئاتهم.[94] مبدآن مترابطان بشكل كبير مهمان للغاية في فهم كيفية التحكم في المسارات الأيضية. الأول، أن تنظيم إنزيم ما في مسار ما هو كيف أن نشاطه يزيد ويقل استجابة لإشارات. الثاني، أن التحكم الذي يبذله ذلك الإنزيم هو تأثير تلك التغيرات في نشاطه على المعدل الكلي للمسار.[95] على سبيل المثال، قد يُظهر إنزيم ما تغيرات كبيرة في نشاطه (أي أنه منظم بشكل كبير) لكن إذا كانت تلك التغيرات لها أثر بسيط على معدل المسار الأيضي، فإن هذا الإنزيم ليس مساهما في التحكم في ذلك المسار.[96]
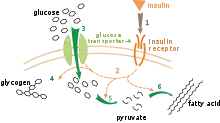
توجد العديد من مستويات تنظيم الأيض. في التنظيم الداخلي، يقوم المسار الأيضي بتنظيم نفسه ليستجيب للتغيرات في مستويات الركائز أو المنتجات، على سبيل المثال، نقص كمية المادة المنتجة يزيد التدفق عبر المسار من أجل التعويض. يتضمن هذا النوع من التنظيم عادة تنظيم تفارغي لنشاطات العديد من الإنزيمات في المسار.[97] يتضمن التحكم الخارجي في كائن متعدد الخلايا أن تقوم خلية بتعيير أيضها استجابة لإشارات من خلايا أخرى. تلك الإشارات عادة تكون في صورة رسل ذائبة مثل الهرمونات وعوامل النمو ويتم اكتشفها بواسطة مستقبلات على سطح الخلية.[98] يتم بعد ذلك بث تلك الإشارات داخل الخلية بواسطة أنظمة الرسول الثاني التي تشارك غالبا في فسفرة البروتينات.[99]
نموذج مفهوم جدا للتحكم الخارجي هو تنظيم أيض الجلوكوز بواسطة هرمون الإنسولين.[100] يتم إنتاج الإنسولين استجابة لارتفاع سكر الدم. ارتباط الهرمون بمستقبلة الإنسولين على الخلايا ينشط سلسة من البروتين كيناز التي تؤدي لاستيعاب الخلايا للجلوكوز من الدم وتحويله إلى جزيئات تخزين مثل الأحماض الدهنية والغلايكوجين.[101] يتم التحكم في أيض الغلايكوجين عبر نشاط إنزيم فوسفوريلاز، وهو الإنزيم الذي يكسر الغلايكوجين، وغلايكوجين سينثاز، الإنزيم الذي يصنعه. يتم تنظيم تلك الإنزيمات بشكل متبادل، حيث تثبط الفسفرة غلايكوجين سينثاز، وتنشط فوسفوريلاز. يتسبب الإنسولين في تصنيع الغلايكوجين عن طريق تنشيط فوسفاتاز البروتين والتسبب في نقص فسفرة تلك الإنزيمات.[102]
التطور
المسارات المركزية للأيض المذكورة سابقًا، مثل تحلل الجلوكوز، ودورة حمض الستريك، تتواجد في النطاقات الثلاثة للكائنات الحية وكانت متواجدة كذلك في السلف الشامل الأخير.[103][104] كانت خلية السلف الشامل بدائية النوى ومولدة للميثان غالبا وبها الكثير من أيض الحمض الأميني، والنوكوليوتيد، والسكريات، والدهون.[105][106] قد يكون الإبقاء على هذه المسارات القديمة خلال التطور المتأخر ناتجا عن أن هذه التفاعلات كانت الحل الأمثل لمشاكلهم الأيضية الخاصة، مع مسارات مثل تحلل الجلوكوز ودورة حمض الستريك تنتج نواتجها النهائية بفعالية عالية وبعدد محدود من الخطوات.[107][108] قد تكون المسارات الأولى في الأيض القائم على الإنزيمات جزءًا من أيض نوكليوتيد البيورين، فيما كانت مسارات الأيض السابقة جزءًا منفرضية عالم الحمض النووي الريبوزي القديمة.[109]
تم اقتراح العديد من النماذج لوصف آليات تطور مسارات الأيض الحديثة. تشمل تلك النماذج إضافات متتابعة لإنزيمات جديدة لمسارات قديمة قصيرة، وتضاعف ثم تشعب المسارات بالكامل بالإضافة لتوظيف الانزيمات الموجودة مسبقا وتجميعها في مسار تفاعل جديد.[110] الأهمية النسبية لتلك الآليات غير واضحة، إلا أن دراسات جينومية أظهرت أن الإنزيمات في مسار ما من المحتمل أن يكون لها سلف مشترك، ما يقترح أن العديد من المسارات قد تطورت خطوة بخطوة مع تكوُّن وظائف جديدة من الخطوات الموجودة سابقًا في المسار.[111] نموذج بديل ظهر من دراسات تتبع تطور تركيب البروتيان في شبكة الأيض، اقترح ذلك النموذج أن الإنزيمات يتم توظيفها بشكل واسع، واستعارة إنزيمات لتأدية وظائف مشابهة في مسارات أيضية مختلفة.[112] تؤدي عملية التوظيف تلك إلى تنوع في التطور الإنزيمي.[113] احتمال ثالث هو أن بعض أجزاء الأيض قد تتواجد في «وحدات» يمكن إعادة استخدماها في مسارات مختلفة وتؤدي نفس الوظائف على جزيئات مختلفة.[114]
بالإضافة لتطور مسارات أيضية جديدة، يمكن أن يسبب التطور كذلك فقد بعض الوظائف الأيضية. على سبيل المثال، في بعض الديدان فُقدت العمليات الأيضية غير الضرورية للحياة، وعوضًا عنها يمكن استغلال الأحماض الأمينية، والنوكليوتيدات، والسكريات الموجودة مسبقًا في العائل.[115] يمكن ملاحظة أمثلة مشابهة لفقد القدرات الأيضية في كائنات المعايشة الجوانية.[116]
الاستقصاء والمعالجة
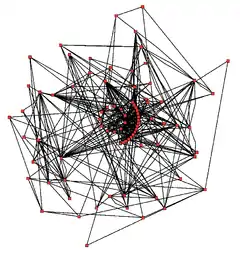
بشكل تقليدي، تتم دراسة الأيض بمقاربة اختزالية تركز على مسار أيضي واحد. استعمال القائفات المشعة مفيد بشكل خاص في تعقب الكائن بالكامل، وعلى مستوى النسيج، والخلية، والذي يحدد المسار من المركب الطليعي حتى الناتج النهائي عن طريق التعرف على الوسائط والمنتجات المعلمة بمادة مشعة.[117] الإنزيمات التي تحفز تلك التفاعلات الكيميائية يمكن بعد ذلك تنقيتها ودراسة حركياتها واستجابتها للمثبطات. مقاربة موازية هي التعرف على الجزئيات الصغيرة في خلية أو نسيج، المجموعة الكاملة من تلك الجزيئات تسمى ميتابولوم. بشكل عام، تعطي تلك الدراسات نظرة جيدة على تركيب ووظيفة المسارات الأيضية البسيطة، لكنها غير كافية عند تطبيقها على أنظمة أكثر تعقيدا مثل أيض خلية كاملة.[118]
يمكن الحصول على فكرة عن مدى تعقيد شبكات الأيض في الخلايا التي تحتوي على آلاف الإنزيمات المختلفة عن طريق الشكل الموضح في الصورة الذي يعرض التفاعلات بين 43 بروتينًا و40 مستقلبًا فقط: توفر تسلسلات الجينومات قوائم تحتوي على ما يصل إلى 45,000 جين.[119] مع ذلك، من الممكن الآن استخدام تلك البيانات الجينومية لإعادة تشكيل شبكات كاملة من التفاعلات الكيميائية الحيوية وإنتاج نماذج رياضية أكثر كلية قد تشرح وتتوقع سلوكياتهم.[120] تلك النماذج قوية بشكل خاص حين تستخدم لدمج بيانات المسار والمستقلب المحصول عليها عبر الطرق التقليدية مثل التعبير الجيني من الدراسات البروتيومية ومصفوفة دي إن إيه الدقيقة.[121] باستخدام تلك الطرق، تم إنتاج نموذج لأيض الإنسان، ما سيساعد في اكتشاف أدوية مستقبلية وأبحاث الكيمياء الحيوية.[122] تستخدم تلك النماذج الآن في تحليل الشبكات، لتصنيف أمراض الإنسان في مجموعات تتشارك في بروتينات أو مستقلبات مشتركة.[119][120]
تعد شبكات الأيض البكتيرية مثالا صارخًا على تنظيم ربطة العنق على شكل قوس،[123][124] وهو تركيب قادر على إدخال نطاق واسع من المغذيات وإنتاج مجموعة كبيرة من المنتجات والجزيئات الكبيرة المعقدة باستخدام تداولات وسيطة مشتركة قليلة نسبيًا.
تطبيق تكنولوجي كبير لتلك المعلومات هو الهندسة الأيضية. وفيها يتم تعديل بعض الكائنات كالخميرة، أو النباتات، أو البكتيريا جينيًا لجعلهم أكثر فائدة في التكنولوجيا الحيوية وللمساعدة في إنتاج أدوية مثل المضادات الحيوية أو الكيماويات الصناعية مثل حمض الشيكيميك.[125] تهدف تلك التعديلات الجينية عادة لتقليل كم الطاقة المستخدم لإنتاج المنتج، وزيادة الإنتاجية، وتقليل مخلفات الإنتاج.[124]
التاريخ
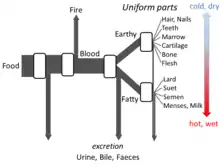
يحتوي كتاب أجزاء الحيوان لأرسطو على تفاصيل كافية عن وجهة نظره بشأن الأيض تكفي لصنع نموذج تدفق مفتوح. حيث آمن أن كل مرحلة من العملية، يتم فيها تحويل مواد من الطعام، مع إطلاق حرارة باعتباره العنصر التقليدي للحريق، وفضلات يتم إخراجها في صورة بول، أو براز، أو صفراء.[126]
وصف ابن النفيس الأيض في عام 1260 في روايته الرسالة الكاملية في السيرة النبوية والتي احتوت عبارة «كل من الجسم وأجزاءه في حالة مستمرة من الانحلال والبناء، لذلك هي حتما تمر بتغيير دائم.»[127] يمتد تاريخ الدراسة العلمية للتمثيل الغذائي لعدة قرون وانتقل من دراسة الحيوانات بالكامل في الدراسات المبكرة، لدراسة التفاعلات الأيضية المفردة في الكيمياء الحيوية الحديثة. تم نشر التجارب المخططة الأولى لأيض الإنسان في 1614 بواسطة سانتوريو سانتوري في كتابه حرق الطب الساكن.[128] وصف فيه كيف وزن نفسه قبل وبعد الأكل، والنوم، والعمل، وممارسة الجنس، والصوم، والشرب، والإخراج. حيث وجد أن أغلب الطعام الذي تناوله قد فقد عبر ما أسماه «عرق غير ملموس».

في تلك الدراسات المبكرة، لم يتم التعرف على آليات تلك العمليات الأيضية وكان من المعتقد أن هناك قوة حيوية تنشط الأنسجة الحية.[129] في القرن الـ19، عند دراسة تخمير السكر إلى كحول بواسطة الخميرة، استنتج لويس باستور أن التخمير تم تحفيزه بواسطة مواد في خلايا الخميرة أسماها «مخمرات». كتب أن «التخمير الكحولي هو عمل مرتبط بحياة وتنظيم خلايا الخميرة، وليس مع موت أو تعفن الخلايا.»[130] هذا الاكتشاف، إلى جانب ما نشره فريدرش فولر في 1828 عن بحث حول التصنيع الكيميائي لليوريا،[131] وكونها أول مركب عضوي يحضر بالكامل من مركبات طليعية غير عضوية أثبتا أن المركبات العضوية والتفاعلات الكيميائية الموجودة في الخلية لا تختلف من حيث المبدأ عن أي جزء من الكيمياء.
كان اكتشاف الإنزيمات في بدايات القرن الـ20 بواسطة إدوارد بوخنر هو ما فصل دراسة تفاعلات الأيض الكيميائية عن الدراسة البيولوجية للخلايا، وأشار ببدء الكيمياء الحيوية.[132] نما حجم المعرفة الكيميائية الحيوية بسرعة خلال أوائل القرن الـ20. أحد أكثر علماء الكيمياء الحيوية الجدد المثمرين وقتها كان هانس كريبس الذي قدم إسهامات هائلة في دراسة الأيض.[133] اكتشف كريبس دورة اليوريا ولاحقًا، بالتعاون مع هانز كورنبيرج، دورة حمض الستريك ودورة الجلايكسولات.[134] تمت مساعدة أبحاث الكيمياء الحيوية الحديثة بشكل كبير بسبب تطور التقنيات الحديثة مثل الاستشراب، ودراسة البلورات بالأشعة السينية، ومطيافية الرنين المغناطيسي النووي، والوسم النظيري، والمجهر الإلكتروني. سمحت تلك التقنيات باكتشاف والتحليل المفصل للعديد من الجزيئات والمسارات الأيضية في الخلايا.
انظر أيضًا
مراجع
- كتاب الأحياء، للصف الثالث الثانوي، طبعة عام 2015-2016، صفحة 33، جمهورية مصر العربية. نسخة محفوظة 2020-08-13 على موقع واي باك مشين.
- كتاب العلوم الحياتية، الصف الثاني الثانوي، الفرع العلمي والزراعي، صفحة 47، دولة فلسطين. نسخة محفوظة 02 سبتمبر 2017 على موقع واي باك مشين.
- كتاب العلوم الحياتية، الصف التاسع، الجزء الأول، صفحة 64، طبعة عام 2012، المملكة الأردنية الهاشمية.
- كتاب الأحياء، الصف الأول الثانوي، طبعة عام 2013، مسار العلوم الطبيعية، صفحة 254، المملكة العربية السعودية[وصلة مكسورة]. نسخة محفوظة 25 أغسطس 2021 على موقع واي باك مشين.
- كتاب علم الأحياء، الصف السادس العلمي، الطبعة الرابعة لعام 2015، صفحة 30، دولة العراق. نسخة محفوظة 25 يونيو 2017 على موقع واي باك مشين.
- كتاب المعلم لمادة الأحياء، الصف الثاني عشر، الفرع العلمي، الجزء الأول، صفحة 91، دولة الإمارات العربية المتحدة. نسخة محفوظة 16 سبتمبر 2017 على موقع واي باك مشين.
- كتاب علم الأحياء وعلم الأرض، الصف الثالث الثانوي، الفرع العلمي، صفحة 54، دولة اليمن. نسخة محفوظة 26 يوليو 2017 على موقع واي باك مشين.
- كتاب الأحياء، السنة الثانية لمرحلة التعليم الثانوي، القسم العلمي، الطبعة السادسة لعام 2014، صفحة 73، الجماهيرية الليبية. نسخة محفوظة 27 مارس 2020 على موقع واي باك مشين.
- كتاب علوم الطبيعة والحياة، السنة الأولى من التعليم الثانوي، صفحة 239، جمهورية الجزائر نسخة محفوظة 09 يوليو 2017 على موقع واي باك مشين.
- كتاب الأحياء، الصف الثاني عشر، الجزء الأول، صفحة 70، دولة الكويت. نسخة محفوظة 26 نوفمبر 2016 على موقع واي باك مشين.
- كتاب علم الأحياء، الصف الثالث الثانوي العلمي، طبعة 2014-2015، صفحة 101، الجمهورية السورية. نسخة محفوظة 10 سبتمبر 2017 على موقع واي باك مشين. [وصلة مكسورة]
- كتاب الأحياء، للصف الثالث الثانوي، طبعة عام 2015-2016، صفحة 30، جمهورية مصر العربية. نسخة محفوظة 2020-08-13 على موقع واي باك مشين.
- "Basics of the virology of HIV-1 and its replication"، J Clin Virol، 34 (4): 233–44، 2005، doi:10.1016/j.jcv.2005.09.004، PMID 16198625.
- "Mechanisms of enzyme-catalyzed group transfer reactions"، Annu Rev Biochem، 47: 1031–78، 1978، doi:10.1146/annurev.bi.47.070178.005123، PMID 354490.
- Mitchell P (1979)، "The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems"، Eur J Biochem، 95 (1): 1–20، doi:10.1111/j.1432-1033.1979.tb12934.x، PMID 378655.
- "Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series"، EMBO Rep، 7 (3): 276–82، مارس 2006، doi:10.1038/sj.embor.7400646، PMID 16607397.
- Coulston, Ann؛ Kerner, John؛ Hattner, JoAnn؛ Srivastava, Ashini (2006)، "Nutrition Principles and Clinical Nutrition"، Stanford School of Medicine Nutrition Courses، SUMMIT.
- "The power to reduce: pyridine nucleotides – small molecules with a multitude of functions"، Biochem J، 402 (2): 205–18، 2007، doi:10.1042/BJ20061638، PMID 17295611.
- "Chemical and elemental analysis of humans in vivo using improved body composition models"، Am J Physiol، 261 (2 Pt 1): E190–8، March 2006، doi:10.1038/sj.embor.7400646، PMID 1872381.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Sychrová H (2004)، "Yeast as a model organism to study transport and homeostasis of alkali metal cations" (PDF)، Physiol Res، 53 Suppl 1: S91–8، PMID 15119939، مؤرشف من الأصل (PDF) في 8 أغسطس 2017.
- Levitan I (1988)، "Modulation of ion channels in neurons and other cells"، Annu Rev Neurosci، 11: 119–36، doi:10.1146/annurev.ne.11.030188.001003، PMID 2452594.
- Dulhunty A (2006)، "Excitation-contraction coupling from the 1950s into the new millennium"، Clin Exp Pharmacol Physiol، 33 (9): 763–72، doi:10.1111/j.1440-1681.2006.04441.x، PMID 16922804.
- "Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight" (PDF)، J Anim Sci، 76 (2): 506–12، 1998، PMID 9498359، مؤرشف من الأصل (PDF) في 17 سبتمبر 2016.
- "Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics"، Anal Bioanal Chem، 378 (1): 171–82، 2004، doi:10.1007/s00216-003-2219-0، PMID 14551660.
- "Transition metal speciation in the cell: insights from the chemistry of metal ion receptors"، Science، 300 (5621): 931–6، 2003، Bibcode:2003Sci...300..931F، doi:10.1126/science.1085049، PMID 12738850.
- "Life: past, present and future"، Philos Trans R Soc Lond B Biol Sci، 354 (1392): 1923–39، 1999، doi:10.1098/rstb.1999.0532، PMID 10670014، مؤرشف من الأصل في 17 مارس 2020، اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "The complex architecture of oxygenic photosynthesis"، Nat Rev Mol Cell Biol، 5 (12): 971–82، 2004، doi:10.1038/nrm1525، PMID 15573135.
- "Bacterial extracellular zinc-containing metalloproteases"، Microbiol Rev، 57 (4): 823–37، December 1993، doi:10.1074/jbc.R600011200، PMID 8302217، مؤرشف من الأصل في 24 فبراير 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - "Bacterial lipases: an overview of production, purification and biochemical properties"، Appl Microbiol Biotechnol، 64 (6): 763–81، 2004، doi:10.1007/s00253-004-1568-8، PMID 14966663.
- Hoyle T (1997)، "The digestive system: linking theory and practice"، Br J Nurs، 6 (22): 1285–91، PMID 9470654.
- "How amino acids get into cells: mechanisms, models, menus, and mediators"، JPEN J Parenter Enteral Nutr، 16 (6): 569–78، 1992، doi:10.1177/0148607192016006569، PMID 1494216.
- "Structure and function of facilitative sugar transporters"، Curr Opin Cell Biol، 11 (4): 496–502، 1999، doi:10.1016/S0955-0674(99)80072-6، PMID 10449337.
- "Structure and function of mammalian facilitative sugar transporters"، J Biol Chem، 268 (26): 19161–4، 1993، PMID 8366068.
- "The cellular fate of glucose and its relevance in type 2 diabetes"، Endocr Rev، 25 (5): 807–30، 2004، doi:10.1210/er.2003-0026، PMID 15466941، مؤرشف من الأصل في 30 أبريل 2011.
- Wipperman, Matthew, F.؛ Thomas, Suzanne, T.؛ Sampson, Nicole, S. (2014)، "Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis"، Crit. Rev. Biochem. Mol. Biol.، 49 (4): 269–93، doi:10.3109/10409238.2014.895700، PMID 24611808.
- "Amino acid metabolism"، Annu Rev Biochem، 32: 355–98، 1963، doi:10.1146/annurev.bi.32.070163.002035، PMID 14144484.
- Brosnan J (2000)، "Glutamate, at the interface between amino acid and carbohydrate metabolism"، J Nutr، 130 (4S Suppl): 988S–90S، PMID 10736367، مؤرشف من الأصل في 6 نوفمبر 2010.
- "Glutamine: the emperor or his clothes?"، J Nutr، 131 (9 Suppl): 2449S–59S, discussion 2486S–7S، 2001، PMID 11533293، مؤرشف من الأصل في 4 أكتوبر 2010.
- "Energy Transduction: Proton Transfer Through the Respiratory Complexes"، Annu Rev Biochem، 75: 165–87، 2006، doi:10.1146/annurev.biochem.75.062003.101730، PMID 16756489.
- "Structures and proton-pumping strategies of mitochondrial respiratory enzymes"، Annu Rev Biophys Biomol Struct، 30: 23–65، 2001، doi:10.1146/annurev.biophys.30.1.23، PMID 11340051.
- "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor"، Trends Biochem Sci، 27 (3): 154–60، 2002، doi:10.1016/S0968-0004(01)02051-5، PMID 11893513.
- "Molecular biology of hydrogen utilization in aerobic chemolithotrophs"، Annu Rev Microbiol، 47: 351–83، 1993، doi:10.1146/annurev.mi.47.100193.002031، PMID 8257102.
- "Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction"، Nat Rev Microbiol، 4 (10): 752–64، 2006، doi:10.1038/nrmicro1490، PMID 16980937.
- Simon J (2002)، "Enzymology and bioenergetics of respiratory nitrite ammonification"، FEMS Microbiol Rev، 26 (3): 285–309، doi:10.1111/j.1574-6976.2002.tb00616.x، PMID 12165429.
- Conrad R (1996)، "Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)"، Microbiol Rev، 60 (4): 609–40، PMID 8987358، مؤرشف من الأصل في 24 فبراير 2020.
- "Microbial co-operation in the rhizosphere"، J Exp Bot، 56 (417): 1761–78، 2005، doi:10.1093/jxb/eri197، PMID 15911555، مؤرشف من الأصل في 26 يوليو 2010.
- "Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park"، Appl Environ Microbiol، 71 (7): 3978–86، يوليو 2005، doi:10.1128/AEM.71.7.3978-3986.2005، PMID 16000812، مؤرشف من الأصل في 24 فبراير 2020.
- "Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism"، J Bacteriol، 183 (21): 6344–54، 2001، doi:10.1128/JB.183.21.6344-6354.2001، PMID 11591679، مؤرشف من الأصل في 24 فبراير 2020.
- "Photosynthetic reaction centers"، FEBS Lett، 438 (1–2): 5–9، 1998، doi:10.1016/S0014-5793(98)01245-9، PMID 9821949.
- "Cyclic electron flow around photosystem I is essential for photosynthesis"، Nature، 429 (6991): 579–82، 2004، Bibcode:2004Natur.429..579M، doi:10.1038/nature02598، PMID 15175756.
- Bouché C, Serdy S, Kahn C, Goldfine A (2004)، "The cellular fate of glucose and its relevance in type 2 diabetes"، Endocr Rev، 25 (5): 807–30، doi:10.1210/er.2003-0026، PMID 15466941، مؤرشف من الأصل في 30 أبريل 2011.
- Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002)، "Crassulacean acid metabolism: plastic, fantastic"، J Exp Bot، 53 (369): 569–80، doi:10.1093/jexbot/53.369.569، PMID 11886877، مؤرشف من الأصل في 25 يناير 2009.
- Sakami W, Harrington H (1963)، "Amino acid metabolism"، Annu Rev Biochem، 32: 355–98، doi:10.1146/annurev.bi.32.070163.002035، PMID 14144484.
- Brosnan J (2000)، "Glutamate, at the interface between amino acid and carbohydrate metabolism"، J Nutr، 130 (4S Suppl): 988S–90S، PMID 10736367، مؤرشف من الأصل في 6 نوفمبر 2010.
- Young V, Ajami A (2001)، "Glutamine: the emperor or his clothes?"، J Nutr، 131 (9 Suppl): 2449S–59S, discussion 2486S–7S، PMID 11533293، مؤرشف من الأصل في 4 أكتوبر 2010.
- Shively J, van Keulen G, Meijer W (1998)، "Something from almost nothing: carbon dioxide fixation in chemoautotrophs"، Annu Rev Microbiol، 52: 191–230، doi:10.1146/annurev.micro.52.1.191، PMID 9891798.
- Hosler J, Ferguson-Miller S, Mills D (2006)، "Energy Transduction: Proton Transfer Through the Respiratory Complexes"، Annu Rev Biochem، 75: 165–87، doi:10.1146/annurev.biochem.75.062003.101730، PMC 2659341، PMID 16756489.
- Schultz B, Chan S (2001)، "Structures and proton-pumping strategies of mitochondrial respiratory enzymes"، Annu Rev Biophys Biomol Struct، 30: 23–65، doi:10.1146/annurev.biophys.30.1.23، PMID 11340051.
- Ensign S (2006)، "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation"، Mol Microbiol، 61 (2): 274–6، doi:10.1111/j.1365-2958.2006.05247.x، PMID 16856935.
- Finn P, Dice J (2006)، "Proteolytic and lipolytic responses to starvation"، Nutrition، 22 (7–8): 830–44، doi:10.1016/j.nut.2006.04.008، PMID 16815497.
- Kornberg H, Krebs H (1957)، "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle"، Nature، 179 (4568): 988–91، Bibcode:1957Natur.179..988K، doi:10.1038/179988a0، PMID 13430766.
- Capaldi R, Aggeler R (2002)، "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor"، Trends Biochem Sci، 27 (3): 154–60، doi:10.1016/S0968-0004(01)02051-5، PMID 11893513.
- Opdenakker G, Rudd P, Ponting C, Dwek R (1993)، "Concepts and principles of glycobiology"، FASEB J، 7 (14): 1330–7، PMID 8224606، مؤرشف من الأصل في 6 أكتوبر 2010.
- McConville M, Menon A (2000)، "Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)"، Mol Membr Biol، 17 (1): 1–16، doi:10.1080/096876800294443، PMID 10824734.
- Chirala S, Wakil S (2004)، "Structure and function of animal fatty acid synthase"، Lipids، 39 (11): 1045–53، doi:10.1007/s11745-004-1329-9، PMID 15726818.
- Friedrich B, Schwartz E (1993)، "Molecular biology of hydrogen utilization in aerobic chemolithotrophs"، Annu Rev Microbiol، 47: 351–83، doi:10.1146/annurev.mi.47.100193.002031، PMID 8257102.
- Weber K, Achenbach L, Coates J (2006)، "Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction"، Nat Rev Microbiol، 4 (10): 752–64، doi:10.1038/nrmicro1490، PMID 16980937.
- Dubey V, Bhalla R, Luthra R (2003)، "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF)، J Biosci، 28 (5): 637–46، doi:10.1007/BF02703339، PMID 14517367، مؤرشف من الأصل (PDF) في 15 أبريل 2007.
- Kuzuyama T, Seto H (2003)، "Diversity of the biosynthesis of the isoprene units"، Nat Prod Rep، 20 (2): 171–83، doi:10.1039/b109860h، PMID 12735695.
- Schroepfer G (1981)، "Sterol biosynthesis"، Annu Rev Biochem، 50: 585–621، doi:10.1146/annurev.bi.50.070181.003101، PMID 7023367.
- Lees N, Skaggs B, Kirsch D, Bard M (1995)، "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review"، Lipids، 30 (3): 221–6، doi:10.1007/BF02537824، PMID 7791529.
- Strauss G, Fuchs G (1993)، "Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle"، Eur J Biochem، 215 (3): 633–43، doi:10.1111/j.1432-1033.1993.tb18074.x، PMID 8354269.
- Wood H (1991)، "Life with CO or CO2 and H2 as a source of carbon and energy"، FASEB J، 5 (2): 156–63، PMID 1900793، مؤرشف من الأصل في 14 مايو 2010.
- Ibba M, Söll D (2001)، "The renaissance of aminoacyl-tRNA synthesis"، EMBO Rep، 2 (5): 382–7، doi:10.1093/embo-reports/kve095، PMC 1083889، PMID 11375928، مؤرشف من الأصل في 01 مايو 2011.
- Lengyel P, Söll D (1969)، "Mechanism of protein biosynthesis"، Bacteriol Rev، 33 (2): 264–301، PMC 378322، PMID 4896351.
- Rudolph F (1994)، "The biochemistry and physiology of nucleotides"، J Nutr، 124 (1 Suppl): 124S–127S، PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006)، "Pyrimidine and purine biosynthesis and degradation in plants"، Annu Rev Plant Biol، 57: 805–36، doi:10.1146/annurev.arplant.57.032905.105421، PMID 16669783.
- Stasolla C, Katahira R, Thorpe T, Ashihara H (2003)، "Purine and pyrimidine nucleotide metabolism in higher plants"، J Plant Physiol، 160 (11): 1271–95، doi:10.1078/0176-1617-01169، PMID 14658380.
- Davies O, Mendes P, Smallbone K, Malys N (2012)، "Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism"، BMB Reports، 45 (4): 259–64، doi:10.5483/BMBRep.2012.45.4.259، PMID 22531138.
- Smith J (1995)، "Enzymes of nucleotide synthesis"، Curr Opin Struct Biol، 5 (6): 752–7، doi:10.1016/0959-440X(95)80007-7، PMID 8749362.
- "The biochemistry of drug metabolism—an introduction: part 1. Principles and overview"، Chem Biodivers، 3 (10): 1053–101، 2006، doi:10.1002/cbdv.200690111، PMID 17193224.
- Danielson P (2002)، "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans"، Curr Drug Metab، 3 (6): 561–97، doi:10.2174/1389200023337054، PMID 12369887.
- "UDP-glucuronosyltransferases"، Curr Drug Metab، 1 (2): 143–61، 2000، doi:10.2174/1389200003339171، PMID 11465080.
- "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily"، Biochem J، 360 (Pt 1): 1–16، نوفمبر 2001، doi:10.1042/0264-6021:3600001، PMID 11695986، مؤرشف من الأصل في 21 أكتوبر 2002.
- "Exploring the microbial biodegradation and biotransformation gene pool"، Trends Biotechnol، 23 (10): 497–506، 2005، doi:10.1016/j.tibtech.2005.08.002، PMID 16125262.
- "Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities"، Environ Microbiol، 7 (12): 1868–82، 2005، doi:10.1111/j.1462-2920.2005.00966.x، PMID 16309386.
- Davies K (1995)، "Oxidative stress: the paradox of aerobic life"، Biochem Soc Symp، 61: 1–31، doi:10.1042/bss0610001، PMID 8660387.
- "Oxidative protein folding in eukaryotes: mechanisms and consequences"، J Cell Biol، 164 (3): 341–6، 2004، doi:10.1083/jcb.200311055، PMID 14757749، مؤرشف من الأصل في 5 يوليو 2008.
- Sies H (1997)، "Oxidative stress: oxidants and antioxidants" (PDF)، Exp Physiol، 82 (2): 291–5، doi:10.1113/expphysiol.1997.sp004024، PMID 9129943، مؤرشف من الأصل (PDF) في 25 مارس 2009.
- "The antioxidants and pro-antioxidants network: an overview"، Curr Pharm Des، 10 (14): 1677–94، 2004، doi:10.2174/1381612043384655، PMID 15134565.
- "Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth"، Biochim Biophys Acta، 1412 (3): 191–211، 1999، doi:10.1016/S0005-2728(99)00065-1، PMID 10482783.
- "Thermodynamics and bioenergetics"، Biophys Chem، 97 (2–3): 87–111، 2002، doi:10.1016/S0301-4622(02)00069-8، PMID 12050002.
- Albert R (2005)، "Scale-free networks in cell biology"، J Cell Sci، 118 (Pt 21): 4947–57، arXiv:q-bio/0510054، doi:10.1242/jcs.02714، PMID 16254242، مؤرشف من الأصل في 25 فبراير 2010.
- Brand M (1997)، "Regulation analysis of energy metabolism"، J Exp Biol، 200 (Pt 2): 193–202، PMID 9050227، مؤرشف من الأصل (PDF) في 8 مارس 2010.
- "Signal transduction networks: topology, response and biochemical processes"، J Theor Biol، 238 (2): 416–25، 2006، doi:10.1016/j.jtbi.2005.05.030، PMID 16045939.
- "Metabolic control"، Essays Biochem، 28: 1–12، 1994، PMID 7925313.
- "Modern theories of metabolic control and their applications (review)"، Biosci Rep، 4 (1): 1–22، 1984، doi:10.1007/BF01120819، PMID 6365197.
- Fell D, Thomas S (1995)، "Physiological control of metabolic flux: the requirement for multisite modulation"، Biochem J، 311 (Pt 1): 35–9، PMC 1136115، PMID 7575476.
- Hendrickson W (2005)، "Transduction of biochemical signals across cell membranes"، Q Rev Biophys، 38 (4): 321–30، doi:10.1017/S0033583506004136، PMID 16600054.
- Cohen P (2000)، "The regulation of protein function by multisite phosphorylation—a 25 year update"، Trends Biochem Sci، 25 (12): 596–601، doi:10.1016/S0968-0004(00)01712-6، PMID 11116185.
- Lienhard G, Slot J, James D, Mueckler M (1992)، "How cells absorb glucose"، Sci Am، 266 (1): 86–91، Bibcode:1992SciAm.266a..86L، doi:10.1038/scientificamerican0192-86، PMID 1734513.
- Roach P (2002)، "Glycogen and its metabolism"، Curr Mol Med، 2 (2): 101–20، doi:10.2174/1566524024605761، PMID 11949930.
- Newgard C, Brady M, O'Doherty R, Saltiel A (2000)، "Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1" (PDF)، Diabetes، 49 (12): 1967–77، doi:10.2337/diabetes.49.12.1967، PMID 11117996، مؤرشف من الأصل (PDF) في 25 مارس 2009.
- Smith E, Morowitz H (2004)، "Universality in intermediary metabolism"، Proc Natl Acad Sci USA، 101 (36): 13168–73، Bibcode:2004PNAS..10113168S، doi:10.1073/pnas.0404922101، PMC 516543، PMID 15340153، مؤرشف من الأصل في 24 فبراير 2020.
- Romano A, Conway T (1996)، "Evolution of carbohydrate metabolic pathways"، Res Microbiol، 147 (6–7): 448–55، doi:10.1016/0923-2508(96)83998-2، PMID 9084754.
- Koch A (1998)، "How did bacteria come to be?"، Adv Microb Physiol، Advances in Microbial Physiology، 40: 353–99، doi:10.1016/S0065-2911(08)60135-6، ISBN 978-0-12-027740-7، PMID 9889982.
- Ouzounis C, Kyrpides N (1996)، "The emergence of major cellular processes in evolution"، FEBS Lett، 390 (2): 119–23، doi:10.1016/0014-5793(96)00631-X، PMID 8706840.
- Ebenhöh O, Heinrich R (2001)، "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems"، Bull Math Biol، 63 (1): 21–55، doi:10.1006/bulm.2000.0197، PMID 11146883.
- Meléndez-Hevia E, Waddell T, Cascante M (1996)، "The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution"، J Mol Evol، 43 (3): 293–303، Bibcode:1996JMolE..43..293M، doi:10.1007/BF02338838، PMID 8703096.
- Caetano-Anolles G, Kim HS, Mittenthal JE (2007)، "The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture"، Proc Natl Acad Sci USA، 104 (22): 9358–63، Bibcode:2007PNAS..104.9358C، doi:10.1073/pnas.0701214104، PMC 1890499، PMID 17517598.
- Schmidt S, Sunyaev S, Bork P, Dandekar T (2003)، "Metabolites: a helping hand for pathway evolution?"، Trends Biochem Sci، 28 (6): 336–41، doi:10.1016/S0968-0004(03)00114-2، PMID 12826406.
- Light S, Kraulis P (2004)، "Network analysis of metabolic enzyme evolution in Escherichia coli"، BMC Bioinformatics، 5: 15، doi:10.1186/1471-2105-5-15، PMC 394313، PMID 15113413. Alves R, Chaleil R, Sternberg M (2002)، "Evolution of enzymes in metabolism: a network perspective"، J Mol Biol، 320 (4): 751–70، doi:10.1016/S0022-2836(02)00546-6، PMID 12095253.
- Kim HS, Mittenthal JE, Caetano-Anolles G (2006)، "MANET: tracing evolution of protein architecture in metabolic networks"، BMC Bioinformatics، 7: 351، doi:10.1186/1471-2105-7-351، PMC 1559654، PMID 16854231.
- Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001)، "Small-molecule metabolsim: an enzyme mosaic"، Trends Biotechnol، 19 (12): 482–6، doi:10.1016/S0167-7799(01)01813-3، PMID 11711174.
- Spirin V, Gelfand M, Mironov A, Mirny L (يونيو 2006)، "A metabolic network in the evolutionary context: Multiscale structure and modularity"، Proc Natl Acad Sci USA، 103 (23): 8774–9، Bibcode:2006PNAS..103.8774S، doi:10.1073/pnas.0510258103، PMC 1482654، PMID 16731630، مؤرشف من الأصل في 24 فبراير 2020.
- Lawrence J (2005)، "Common themes in the genome strategies of pathogens"، Curr Opin Genet Dev، 15 (6): 584–8، doi:10.1016/j.gde.2005.09.007، PMID 16188434. Wernegreen J (2005)، "For better or worse: genomic consequences of intracellular mutualism and parasitism"، Curr Opin Genet Dev، 15 (6): 572–83، doi:10.1016/j.gde.2005.09.013، PMID 16230003.
- Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006)، "Chance and necessity in the evolution of minimal metabolic networks"، Nature، 440 (7084): 667–70، Bibcode:2006Natur.440..667P، doi:10.1038/nature04568، PMID 16572170.
- Rennie M (1999)، "An introduction to the use of tracers in nutrition and metabolism"، Proc Nutr Soc، 58 (4): 935–44، doi:10.1017/S002966519900124X، PMID 10817161.
- Phair R (1997)، "Development of kinetic models in the nonlinear world of molecular cell biology"، Metabolism، 46 (12): 1489–95، doi:10.1016/S0026-0495(97)90154-2، PMID 9439549.
- Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007)، "How many genes are there in plants (... and why are they there)?"، Curr Opin Plant Biol، 10 (2): 199–203، doi:10.1016/j.pbi.2007.01.004، PMID 17289424.
- Borodina I, Nielsen J (2005)، "From genomes to in silico cells via metabolic networks"، Curr Opin Biotechnol، 16 (3): 350–5، doi:10.1016/j.copbio.2005.04.008، PMID 15961036، مؤرشف من الأصل في 6 نوفمبر 2018.
- Gianchandani E, Brautigan D, Papin J (2006)، "Systems analyses characterize integrated functions of biochemical networks"، Trends Biochem Sci، 31 (5): 284–91، doi:10.1016/j.tibs.2006.03.007، PMID 16616498.
- Duarte NC, Becker SA, Jamshidi N, وآخرون (فبراير 2007)، "Global reconstruction of the human metabolic network based on genomic and bibliomic data"، Proc. Natl. Acad. Sci. U.S.A.، 104 (6): 1777–82، Bibcode:2007PNAS..104.1777D، doi:10.1073/pnas.0610772104، PMC 1794290، PMID 17267599، مؤرشف من الأصل في 24 فبراير 2020.
- Ma HW, Zeng AP (2003)، "The connectivity structure, giant strong component and centrality of metabolic networks"، Bioinformatics، 19 (11): 1423–30، CiteSeerX 10.1.1.605.8964، doi:10.1093/bioinformatics/btg177، PMID 12874056.
- Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006)، "Hierarchical modularity of nested bow-ties in metabolic networks"، BMC Bioinformatics، 7: 386، doi:10.1186/1471-2105-7-386، PMC 1560398، PMID 16916470.
- Ma HW, Zeng AP (2003)، "The connectivity structure, giant strong component and centrality of metabolic networks"، Bioinformatics، 19 (11): 1423–30، CiteSeerX 10.1.1.605.8964، doi:10.1093/bioinformatics/btg177، PMID 12874056. González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005)، "Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol"، Metab Eng، 7 (5–6): 329–36، doi:10.1016/j.ymben.2005.06.001، PMID 16095939. Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003)، "Metabolic engineering for microbial production of shikimic acid"، Metab Eng، 5 (4): 277–83، doi:10.1016/j.ymben.2003.09.001، PMID 14642355.
- Leroi, Armand Marie (2014)، The Lagoon: How Aristotle Invented Science، Bloomsbury، ص. 400–401، ISBN 978-1-4088-3622-4.
- Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibn al-Nafis As a Philosopher, Encyclopedia of Islamic World [1])
- Eknoyan G (1999)، "Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies"، Am J Nephrol، 19 (2): 226–33، doi:10.1159/000013455، PMID 10213823.
- Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Retrieved on 2007-03-26 نسخة محفوظة 09 مايو 2012 على موقع واي باك مشين.
- Dubos J. (1951)، "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind"، Trends Biotechnol، 13 (12): 511–515، doi:10.1016/S0167-7799(00)89014-9، PMID 8595136.
- Kinne-Saffran E, Kinne R (1999)، "Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs"، Am J Nephrol، 19 (2): 290–4، doi:10.1159/000013463، PMID 10213830.
- Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 2007-03-20 نسخة محفوظة 13 أغسطس 2018 على موقع واي باك مشين.
- Kornberg H (2000)، "Krebs and his trinity of cycles"، Nat Rev Mol Cell Biol، 1 (3): 225–8، doi:10.1038/35043073، PMID 11252898.
- Krebs HA, Henseleit K (1932)، "Untersuchungen über die Harnstoffbildung im tierkorper"، Z. Physiol. Chem.، 210: 33–66، doi:10.1515/bchm2.1932.210.1-2.33.
Krebs H, Johnson W (أبريل 1937)، "Metabolism of ketonic acids in animal tissues"، Biochem J، 31 (4): 645–60، doi:10.1042/bj0310645، PMC 1266984، PMID 16746382.
روابط خارجية
معلومات عامة
- The Biochemistry of Metabolism
- Sparknotes SAT biochemistry Overview of biochemistry. School level.
- MIT Biology Hypertextbook Undergraduate-level guide to molecular biology.
أيض الإنسان
- Topics in Medical Biochemistry Guide to human metabolic pathways. School level.
- http://themedicalbiochemistrypage.org/ THE Medical Biochemistry Page] Comprehensive resource on human metabolism.
قواعد بيانات
- Flow Chart of Metabolic Pathways at ExPASy
- IUBMB-Nicholson Metabolic Pathways Chart
- SuperCYP: Database for Drug-Cytochrome-Metabolism
مسارات أيضية
- Metabolism reference Pathway
- Krebs HA, Henseleit K (1932)، "Untersuchungen über die Harnstoffbildung im tierkorper"، Z. Physiol. Chem.، 210: 33–66، doi:10.1515/bchm2.1932.210.1-2.33.واي باك مشينKrebs HA, Henseleit K (1932)، "Untersuchungen über die Harnstoffbildung im tierkorper"، Z. Physiol. Chem.، 210: 33–66، doi:10.1515/bchm2.1932.210.1-2.33.
- بوابة أيض
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
- بوابة صيدلة
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة غوص
.svg.png.webp)
