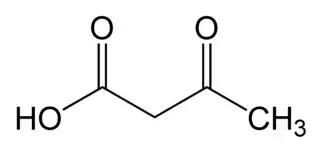
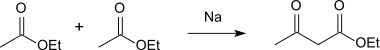Ácido acetoacético
El ácido acetoacético es un ácido carboxílico de fórmula empírica C4H6O3. Es el más simple de los β-cetoácidos y como los demás, es muy inestable y sufre descarboxilación espontánea a acetona. Interviene en el metabolismo de lípidos y es uno de los cuerpos cetónicos, una fuente de energía para el corazón y el cerebro. El anión carboxilato del ácido acetoacético se conoce como acetoacetato, que es la forma más usual en los seres vivos.
| Ácido acetoacético | ||
|---|---|---|
 | ||
 | ||
| General | ||
| Fórmula estructural |
| |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 541-50-4[1] | |
| ChEBI | 15344 | |
| ChEMBL | 1230762 | |
| ChemSpider | 94 | |
| DrugBank | DB01762 | |
| PubChem | 96 | |
| UNII | 4ZI204Y1MC | |
| KEGG | C00164 | |
|
O=C(C)CC(=O)O
| ||
| Propiedades físicas | ||
| Masa molar | 102,088 g/mol | |
| Punto de fusión | 36,5 K (−237 °C) | |
| Propiedades químicas | ||
| Acidez | 3.58[2] pKa | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
En las personas en cetosis nutricional, el acetoacetato y demás cuerpos cetónicos se producen en cantidades metabolicamente normales que no suponen un riesgo para la salud.
Cuando el organismo falla en la regulación de la producción de dichos cuerpos cetónicos, llevando a la acumulación de estos ácidos en sangre y a la disminución drástica del pH sanguíneo, se produce la patología conocida como cetoacidosis que puede llegar a ser letal.
Síntesis
El ácido acetoacético se prepara por saponificación (hidrólisis) del acetoacetato de etilo y reacción posterior con ácidos. Otra posibilidad de preparación es la oxidación del ácido butírico con peróxido de hidrógeno:
En la reacción de acetato de etilo con sodio, el éster etílico del ácido acetoacético se forma en una condensación de Claisen, que puede convertirse en el ácido puro mediante la escisión del éster:[3]
Propiedades
El ácido acetoacético tiene un tautomerismo ceto-enólico. Debido al efecto inductivo del grupo ceto, el ácido acetoacético es más ácido que su ácido butírico de partida.
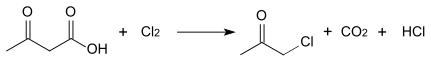
Con cloro o bromo elemental el ácido acetoacético se descompone en dióxido de carbono, el correspondiente haluro de hidrógeno y cloroacetona o bromoacetona:[4]
Usos
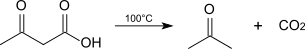
El ácido acetoacético puro apenas se usa porque se descompone fácilmente con la descarboxilación en dióxido de carbono y acetona (rápida a 100 °C).[3] Más importantes son sus ésteres y sales.
Bioquímica
En condiciones fisiológicas típicas, el ácido acetoacético existe como su base conjugada, el acetoacetato.
El acetoacetato se produce en las mitocondrias del hígado a partir de la acetoacetil-CoA. Primero, se agrega otro grupo acetilo a partir de acetil-CoA para formar 3-hidroxi-3-metilglutaril-CoA, luego se pierde un acetil-CoA, produciendo acetoacetato. El acetoacetato inicial puede provenir del último ciclo en la beta oxidación de un ácido graso, o puede sintetizarse a partir de dos moléculas de acetil-CoA, catalizadas por la enzima tiolasa.[5]
En los mamíferos, el acetoacetato producido en el hígado (junto con los otros dos "cuerpos cetónicos") se libera al torrente sanguíneo como fuente de energía durante los períodos de ayuno, ejercicio o como resultado de la diabetes mellitus tipo 1.[6] Primero, un grupo CoA se transfiere enzimáticamente a él desde el succinil-CoA, convirtiéndolo nuevamente en acetoacetil-CoA; luego se divide en dos moléculas de acetil-CoA por la tiolasa, y después ingresan al ciclo del ácido cítrico. El músculo cardíaco y la corteza renal prefieren el acetoacetato a la glucosa. El cerebro usa acetoacetato cuando los niveles de glucosa son bajos debido al ayuno o la diabetes.[5]
Referencias
- Número CAS
- Dawson, R. M. C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- F. Beilstein: Handbuch der organischen Chemie, 3. Auflage, 1. Band. Verlag Leopold Voss, 1893. S. 591. Volltext
- R. Otto: Analogien zwischen Ketonsäuren und alkylsulfonirten Fettsäuren in Berichte der deutschen chemischen Gesellschaft 1888, 21, S. 89–94. Volltext
- Lubert Stryer (1981). Biochemistry (2nd edición).
- Stryer, Lubert (1995). Biochemistry. (Fourth edición). New York: W.H. Freeman and Company. pp. 510–515, 581–613, 775–778. ISBN 0 7167 2009 4.