Ácido carbámico
El ácido carbámico, que también puede denominarse ácido aminofórmico o ácido aminocarboxílico,[2] es un compuesto químico de fórmula H2NCOOH. Puede obtenerse por la reacción del amoníaco NH3 y el dióxido de carbono CO2 a temperaturas muy bajas, que también da lugar al carbamato de amonio [NH4]+[NH2CO2]−. El compuesto es estable sólo hasta unos 250 K (-23 °C); a temperaturas más altas se descompone en esos dos gases.[3] El sólido está formado aparentemente por dímeros, con las dos moléculas conectadas por enlaces de hidrógeno entre los dos grupos carboxilo -COOH.[4]
| Ácido carbámico | ||
|---|---|---|
| General | ||
| Fórmula estructural |
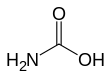 | |
| Fórmula molecular | NH3CO2 | |
| Identificadores | ||
| Número CAS | 463-77-4[1] | |
| ChEBI | 28616 | |
| ChEMBL | CHEMBL125278 | |
| ChemSpider | 271 | |
| DrugBank | 04261 | |
| PubChem | 277 | |
| UNII | O0UC6XOS4H | |
| KEGG | C01563 | |
| Propiedades físicas | ||
| Masa molar | 61,016 g/mol | |
El ácido carbámico podría considerarse tanto una amina como un ácido carboxílico, y por tanto un aminoácido;[3] sin embargo, la unión del grupo carboxilo -COOH directamente al átomo de nitrógeno (sin ninguna cadena de carbono intermedia) hace que se comporte de forma muy diferente a los aminoácidos con cadena de carbono intermedia. (La glicina NH2CH2COOH suele considerarse el aminoácido más simple.) El grupo hidroxilo -OH unido al carbono también lo excluye de la clase de las amidas.
El término "ácido carbámico" también se utiliza genéricamente para cualquier compuesto de la forma RR′NCOOH, donde R y R′ son grupos orgánicos o hidrógeno.[5]
La desprotonación de un ácido carbámico produce un anión carbamato RR′NCOO-, cuyas sales pueden ser relativamente estables. Carbamato es también un término utilizado para ésteres de ácidos carbámicos, como el carbamato de metilo H2N−C(=O)−OCH3. El grupo funcional carbamoilo RR′N-C(=O)- (a menudo denotado por Cbm) es la molécula de ácido carbámico menos la parte OH del carboxilo.
Estructura
El ácido carbámico es una molécula plana.[3]
El grupo H2N- del ácido carbámico, a diferencia de la mayoría de las aminas, no puede protonarse a un grupo amonio H3N+-. La forma zwitteriónica H3N+−COO− es muy inestable y se descompone rápidamente en amoníaco y dióxido de carbono,[6] aunque se ha descrito su detección en hielos irradiados con protones de alta energía.[3]
Derivados
El ácido carbámico es formalmente el compuesto de origen de varias familias importantes de compuestos orgánicos:
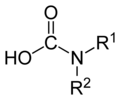 ácidos carbámicos
ácidos carbámicos aniones carbamato
aniones carbamato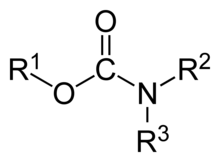 ésteres de carbamato
ésteres de carbamato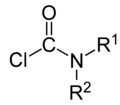 cloruros de carbamoilo
cloruros de carbamoilo
Ácidos carbámicos
Muchos ácidos carbámicos sustituidos (RHNCOOH o RR′NCOOH) pueden sintetizarse fácilmente burbujeando dióxido de carbono a través de soluciones de la amina correspondiente ( RNH2 o RR′NH, respectivamente) en un disolvente apropiado, como DMSO o dióxido de carbono supercrítico.[5] Estos ácidos carbámicos son generalmente inestables a temperatura ambiente, revirtiendo a la amina madre y al dióxido de carbono.[7]
Ésteres de carbamato
A diferencia de los ácidos carbámicos, los ésteres de carbamato suelen ser estables a temperatura ambiente. Se preparan por reacción de cloruros de carbamoilo con alcoholes, la adición de alcoholes a isocianatos y la reacción de ésteres de carbamato con amoníaco.[8] El carbamato de metilo y el carbamato de etilo se encuentran entre los ejemplos más sencillos y se han utilizado históricamente en la industria textil; en la actualidad, ambos son sospechosos de ser cancerígenos. También se conoce el carbamato de bencilo.
Presencia en la naturaleza
La enzima carbamato quinasa, implicada en varias rutas metabólicas de organismos vivos, cataliza la formación de carbamoil fosfato H
2N−C(=O)−O−PO2−
3:
ATP + NH
3 + CO
2 ⇌ ADP + H
2N−C(=O)−O−PO2−
3
Una molécula de hemoglobina puede transportar a los pulmones cuatro moléculas de dióxido de carbono en forma de grupos carbamato formados por reacción del CO2 con cuatro grupos amina terminales de la forma desoxi. El compuesto resultante se denomina carbaminohemoglobina.
Usos
Industrial
El ácido carbámico es un intermediario en la producción industrial de urea, que implica la reacción de dióxido de carbono y amoníaco.[9]
- CO
2 + NH
3 → H
2NCOOH - H
2NCOOH + NH
3 → CO(NH
2)
2 + H
2O
Medicina
Algunos ésteres de carbamato se utilizan como relajantes musculares, como el emilcamato, el fenprobamato, el estilramato y otros miembros del código ATC M03BA. Se unen al sitio barbitúrico del receptor GABAA. [10]
Insecticidas
Se han desarrollado varios insecticidas a base de ácido carbámico; por ejemplo, aldicarb, carbaril, carbofurano.[11]
Síntesis química
Un grupo funcional amina -NH2 puede protegerse de reacciones no deseadas formando un residuo de éster carbámico -NHC(=O)-OR. La hidrólisis del enlace éster produce entonces un ácido carbámico -NHC(=O)OH, que pierde entonces dióxido de carbono dando lugar a la amina deseada.
Referencias
- Número CAS
- «PubChem Compound Summary for CID 277, Carbamic acid». National Center for Biotechnology Information. 2020. Consultado el 10 de octubre de 2020.
- R. K. Khanna and M. H. Moore (1999): "Carbamic acid: molecular structure and IR spectra". Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, volume 55, issue 5, pages 961-967. doi 10.1016/S1386-1425(98)00228-5 PubMedBibcode: 1999AcSpA..55..961K
- J. B. Bossa, P. Theulé, F. Duvernay, F. Borget and T. Chiavassa (2008): "Carbamic acid and carbamate formation in NH3:CO2 ices – UV irradiation versus thermal processes". Astronomy and Astrophysics, volume 492, issue 3, pages 719-724. doi 10.1051/0004-6361:200810536
- Z. J. Dijkstra, A. R. Doornbos, H. Weyten, J. M. Ernsting, C. J. Elsevier, and J. T. F. Keurentjes (2007): "Formation of carbamic acid in organic solvents and in supercritical carbon dioxide". Journal of Supercritical Fluids, volume 41, issue 1, pages 109-114. doi 10.1016/j.supflu.2006.08.012
- Y.-J. Chen, M. Nuevo, J.-M. Hsieh, T.-S. Yih, W.-H. Sun, W.-H. Ip, H.-S. Fung, S.-Y. Chiang, Y.-Y. Lee, J.-M. Chen and C.-Y. R. Wu (2007): "Carbamic acid produced by the UV/EUV irradiation of interstellar ice analogs". Astronomy and Astrophysics, volume 464, issue 1, pages 253-257. doi 10.1051/0004-6361:20066631
- Lemke, Thomas L. (2003). Review of Organic Functional Groups: Introduction to Medicinal Organic Chemistry. Philadelphia, PA: Lippincott, Williams & Wilkins. p. 63. ISBN 978-0-7817-4381-5.
- Jäger, Peter; Rentzea, Costin N.; Kieczka, Heinz (2000). «Carbamates and Carbamoyl Chlorides». Ullmann's Encyclopedia of Industrial Chemistry. ISBN 3527306730. doi:10.1002/14356007.a05_051.
- Meessen, Jozef H.; Petersen, Harro (15 de junio de 2000). Wiley-VCH Verlag GmbH & Co. KGaA, ed. Urea (en inglés). Wiley-VCH Verlag GmbH & Co. KGaA. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a27_333. Consultado el 24 de agosto de 2023.
- Block, John H.; Beale, John M., eds. (2004). «Central Nervous System Depressant». Wilson and Gisvold's Textbook of Organic Medicinal and Pharmaceutical Chemistry. Philadelphia, PA: Lippincott, Williams & Wilkins. p. 495. ISBN 978-0-7817-3481-3.
- Risher, John F.; Mink, Franklin L.; Stara, Jerry F. (1987). «The Toxicologic Effects of the Carbamate Insecticide Aldicarb in Mammals: A Review». Environmental Health Perspectives 72: 267-281. JSTOR 3430304. PMC 1474664. PMID 3304999. doi:10.2307/3430304.
Enlaces externos
- Esta obra contiene una traducción derivada de «Carbamic acid» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.