Ácido cloroplatínico
El ácido cloroplatínico o ácido hexacloroplatínico es un compuesto inorgánico que normalmente se encuentran como hexahidrato de fórmula H2PtCl6·(H2O)6. Este es uno de los compuestos más fácilmente disponibles solubles de platino. Rara vez se obtiene en estado puro. El producto comercial es el oxonio sal del hexacloroplatinato (IV) de aniones. Por lo tanto, la fórmula correcta es [H3O]2[PtCl6]·4H2O.[2][3] El compuesto de paladio similar, [H3O]2[PdCl6] es muy inestable y no se ha aislado en forma pura.[4]
| Ácido cloroplatínico | ||
|---|---|---|
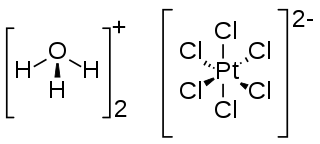 | ||
 | ||
| Nombre IUPAC | ||
| Dihidrógeno hexacloroplatinato (2 -) | ||
| General | ||
| Otros nombres | Ácido cloroplatínico | |
| Fórmula estructural | H2PtCl6·(H2O)6 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 16941-12-1[1] | |
| Propiedades físicas | ||
| Apariencia | Marrón rojizo sólido | |
| Densidad | 2431 kg/m³; 2,431 g/cm³ | |
| Masa molar | 409,81 g/mol | |
| Punto de fusión | 60 °C (333 K) | |
| Peligrosidad | ||
| NFPA 704 |
0
2
1
| |
| Frases R | R25, R34, R42/43 | |
| Frases S | S1/2, S22, S26, S36/37/39, S45 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis

El ácido cloroplatínico se produce por disolución de un esponja de platino en agua regia. Se cree que esta reacción puede producir compuestos nitrogenados de platino, pero el producto es H2PtCl6. El ácido cloroplatínico es de color marrón-rojo, y se puede aislar por evaporación de esta solución hasta un jarabe.[5]
Otros métodos han sido muy investigado, pero la literatura más antigua pueden ser poco fiables.[6]
- Disolución de platino en caliente en ácido clorhídrico concentrado con cloro burbujeante:
- La electrólisis de ácido clorhídrico concentrado con el ánodo de platino:
- La disolución de óxido de platino (IV) en ácido clorhídrico concentrado:
- La reacción de cloruro de platino (IV) con concentrado de ácido clorhídrico :
- Descomposición tetracloroplatinato (II) de hidrógeno :
- Reacción tetracloroplatinato (II) de hidrógeno con cloro :
Reacciones
Cuando el ácido hexacloroplatínico se calienta, se descompone a través de platino (IV) cloruro y platino (II), cloruro de platino elemental, aunque las reacciones no se producen por etapas, limpiamente:[2]
- (H3O)2PtCl6·n H2O
 PtCl4 + 2 HCl + (n + 2) H2O
PtCl4 + 2 HCl + (n + 2) H2O
- PtCl4
 PtCl2 + Cl2
PtCl2 + Cl2
- PtCl2
 Pt + Cl2
Pt + Cl2
Las tres reacciones son reversibles.
Aplicaciones
Determinación de potasio
Ácido cloroplatínico fue popularizado para la determinación de potasio. El potasio se precipita selectivamente como cloroplatinato de potasio. Las determinaciones se realizaron en 85% (v / v) de alcohol con el exceso de iones platinato, y el producto precipitado se pesó. El potasio puede ser detectado por soluciones tan diluida como 0,02 a 0,2% (m / v).[7]
Este método para la determinación de potasio era ventajoso frente al método cobaltinitrito utilizado anteriormente, ya que requiere una sola reacción de precipitación. Hoy en día, la concentración de potasio se determina con un electrodo selectivo de iones. Estos métodos modernos siguen estando sujetos a interferencias.
Purificación del platino
El tratamiento con una sal de amonio, tal como cloruro de amonio, da hexacloroplatinato de amonio,[8] que es muy insoluble en soluciones de amonio. El calentamiento de la sal de amonio en hidrógeno se reduce a platino elemental. El platino es a menudo aislado a partir de minerales o reciclado de los residuos de esta manera.[9]
Catálisis
Al igual que muchos compuestos de platino, el ácido cloroplatínico se utiliza en la catálisis. Este compuesto fue reportado por primera vez por John Speier y colegas de la Dow Corning Corporation para catalizar la reacción de hidruros de sililo con olefinas, hidrosililación. Típica de sus reacciones, Speier utilizado soluciones de isopropanol que contiene triclorosilano (SiHCl3), y metildiclorosilano (CH3HSiCl2), con pentenos. Los procesos anteriores sobre la adición de silanos a los alquenos requiere reacciones de radicales que eran ineficaces.[10][11] En general se acepta que el ácido cloroplatínico es un precursor de catalizador. También se ha considerado un posible papel de platino coloidal o complejos de valencia cero.[12]
Compuestos relacionados
El ácido cloroplatínico preparado a partir de agua regia esta a veces contaminado con dinitrosilo hexacloroplatinato (NO)2PtCl6. Esta sustancia se obtiene por la reacción de cloruro de nitrosilo NOCl y platino metálico.[13]
Referencias
- Número CAS
- A. E. Schweizer, G. T. Kerr (1978). «Thermal Decomposition of Hexachloroplatinic Acid». Inorg. Chem. 17 (8): 2326-2327. doi:10.1021/ic50186a067.
- Holleman, Wiberg (2001). Inorganic Chemistry (First edición). New York: Academic Press. ISBN 0-12-352651-5.
- Greenwood, N.N.; Earnshaw, A. (1997). Chemistry of the Elements (Second edición). New York: Elsevier Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- George B. Kauffman; Thurner, Joseph J.; Zatko, David A. (1967). «Ammonium Hexachloroplatinate(IV)». Inorganic Syntheses 9: 182-185. doi:10.1002/9780470132401.ch51.
- Paul Rudnick and R. D. Cooke (1917). «The Preparation of Hydrochloroplatinic Acid by means of Hydrogen Peroxide». J. Am. Chem. Soc. 39 (4): 633-635. doi:10.1021/ja02249a011.
- G. F. Smith, J. L. Gring (1933). «The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium». J. Am. Chem. Soc. 55 (10): 3957-3961. doi:10.1021/ja01337a007.
- George B. Kauffman; Thurner, Joseph J.; Zatko, David A. (1967). «Ammonium Hexachloroplatinate(IV)». Inorganic Syntheses 9: 182-185. doi:10.1002/9780470132401.ch51.
- Cotton, S. A. Chemistry of Precious Metals, Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
- J. L. Speier, J. A. Webster, G. H. Barnes (1957). «The Addition of Silicon Hydrides to Olefinic Double Bonds. Part II. The Use of Group VIII Metal Catalysts». J. Am. Chem. Soc. 79 (4): 974-979. doi:10.1021/ja01561a054.
- John C. Saam, John L. Speier (1958). «The Addition of Silicon Hydrides to Olefinic Double Bonds. Part III. The Addition to Non-terminal Olefins in the Presence of Chloroplatinic Acid». J. Am. Chem. Soc. 80 (15): 4104-4106. doi:10.1021/ja01548a073.
- L. N. Lewis, K. G. Sy, G. L. Bryant and P. E. Donahue (1991). «Platinum-catalyzed hydrosilylation of alkynes». Organometallics 10 (10): 3750-3759. doi:10.1021/om00056a055.
- R. T. Moravek, G. B. Kauffman and T. Mahmood (1967). «Nitrosyl Hexachloroplatinate(IV)». Inorganic Syntheses 9: 217-220. doi:10.1002/9780470132555.ch63.
