Óxido de manganeso(II)
El óxido de manganeso(II) es un compuesto inorgánico cuya fórmula química es MnO.[2] Forma cristales verdes y es inodoro. Es el óxido iónico más simple. Aunque está clasificado como una base muy fuerte, cuando está disuelto no es corrosivo y no ataca la piel. Se puede encontrar en la naturaleza como el mineral raro manganosita.
| Óxido de manganeso(II) | ||
|---|---|---|
-oxide-xtal-3D-SF.png.webp) | ||
 | ||
| General | ||
| Fórmula molecular | MnO | |
| Identificadores | ||
| Número CAS | 1344-43-0[1] | |
| Número RTECS | OP0900000 | |
| PubChem | 14940 | |
| Propiedades físicas | ||
| Apariencia | cristales verdes | |
| Masa molar | 70,937 g/mol | |
| Punto de fusión | 1945 °C (2218 K) | |
| Índice de refracción (nD) | 2.16 | |
| Propiedades químicas | ||
| Solubilidad en agua | Insoluble; soluble en ácido. | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades químicas
Basicidad
El anión óxido (O2-) en óxidos de manganeso iónicos tales como el óxido de manganeso(II) puede asimilar un protón por recombinación:
- O2- + H+ → HO-
Debido a esta captura de un protón (H+), el óxido de manganeso(II) tiene carácter básico. En solución acuosa, tiene un valor pKb de ~ -38. Una solución saturada tiene un pOH casi neutro, lo que indica que la mayoría de los iones óxido se asocian.
- O2 + H2O- es en un equilibrio favorecido con 2 HO-
Estructura
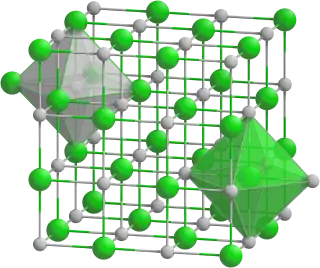
El MnO tiene la estructura de sal de roca al igual que el NaCl, donde cationes y aniones son ambos coordinados octaédricamente.[3] La composición de MnO puede variar, puesto que[4] debajo de 118 K MnO es antiferromagnético.[3] El MnO tiene la distinción de ser uno de los primeros compuestos en tener su estructura magnética determinada por difracción de neutrones en 1951.[5] Este estudio mostró que los iones Mn2+ forman una centrada en las caras cúbico magnético donde hay hojas ferromagnéticamente acopladas que son anti-paralelas con hojas adyacentes.
Reacciones químicas
Tras el tratamiento con un ácido estándar, se obtiene una sal de manganeso y agua.[3] La oxidación de óxido de manganeso(II) da como producto dióxido de manganeso.
Preparación
El MnO se puede preparar por la reducción de cualquier óxido superior con hidrógeno[3] por ejemplo:
- MnO2 + H2 → MnO + H2O
Comercialmente se prepara por reducción de MnO2 con hidrógeno, monóxido de carbono o metano:
- MnO2 + CO + CO2 → MnO
Del mismo modo, se puede sintetizar por calentamiento de MnCO3:[6]
- MnCO3 → MnO + CO2
Este proceso de calcinación se lleva a cabo anaeróbicamente para evitar la formación de Mn2O3.
Aplicaciones
Junto con el sulfato de manganeso, el MnO es un componente de aditivos de fertilizantes y productos alimenticios. Miles de toneladas se consumen anualmente con este propósito.
Otros usos incluyen el catalizador en la fabricación de alcohol alílico, cerámicas, pinturas, vidrio coloreado, sebo de blanqueo e impresión textil.
Véase también
Referencias
- Número CAS
- Arno H. Reidies "Manganese Compounds" Ullmann's Encyclopedia of Chemical Technology 2007; Wiley-VCH, Weinheim. doi 10.1002/14356007.a16_123
- Greenwood; Earnshaw, Norman N.;Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- J.E Greedon, (1994), Magnetic oxides in Encyclopedia of Inorganic chemistry Ed. R. Bruce King, John Wiley & Sons ISBN 0-471-93620-0
- Neutron Diffraction by Paramagnetic and Antiferromagnetic Substances C. G. Shull, W. A. Strauser, and E. O. Wollan, Phys. Rev. 83, 333 - 345 (1951), doi 10.1103/PhysRev.83.333
- W.H. McCarroll (1994) Oxides- solid sate chemistry, Encyclopedia of Inorganic chemistry Ed. R. Bruce King, John Wiley & Sons ISBN 0-471-93620-0
Enlaces externos
- Esta obra contiene una traducción parcial derivada de «Manganese(II) oxide» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.