Acidosis metabólica
La acidosis metabólica es uno de los trastornos del equilibrio ácido-base, caracterizado por un incremento en la acidez del plasma sanguíneo y es, por lo general, una manifestación de trastornos metabólicos en el organismo. El identificar la enfermedad desencadenante es la clave para la corrección del trastorno.
| Acidosis metabólica | ||
|---|---|---|
 | ||
| Especialidad |
nefrología medicina intensiva medicina interna | |
Etiología
La acidosis metabólica puede ser causada por:[1]
- Aumento en la generación de H+ de origen endógeno (por ejemplo, cetonas) o ácidos exógenos (por ejemplo, salicilatos, etilenglicol, metanol).
- Incapacidad de los riñones para excretar el hidrógeno producido por la ingesta de proteínas de la dieta (acidosis tubular renal Tipo I, IV).
- La pérdida de bicarbonato (HCO3) debido a la pérdida-a través del riñón (acidosis tubular renal tipo II) o del tracto gastrointestinal (diarrea).
Cuadro clínico
Los síntomas de una acidosis metabólica no son específicos, y el diagnóstico puede ser complicado a menos que el paciente presente indicaciones claras para el muestreo de gases en sangre arterial. Los síntomas incluyen el dolor de pecho, palpitaciones, dolor de cabeza, alteración del estado mental, incluyendo la ansiedad severa debido a hipoxia, disminución de la agudeza visual, náuseas, vómitos, dolor abdominal, alteración del apetito y pérdida de peso (a largo plazo), debilidad muscular y dolor de los huesos. Los que están en una situación de acidosis metabólica suelen presentar la respiración de Kussmaul, una respiración profunda, rápida, asociada con cetoacidosis diabética clásica. Las respiraciones rápidas y profundas aumentan la cantidad de dióxido de carbono exhalado, lo que conlleva a una reducción de los niveles de dióxido de carbono sérico, causando algún grado de compensación. La sobre-compensación por medio de una alcalosis respiratoria para producir alcalemia no ocurre.
La acidemia extrema conduce a complicaciones neurológicas y cardíacas:
- Neurológicas: letargo, estupor, coma, convulsiones.
- Cardíacos: arritmias (taquicardia ventricular), disminución en la respuesta a la epinefrina; ambas conducen a la hipotensión arterial.
El examen físico revela ocasionalmente signos de enfermedad, pero por lo demás resulta normal. En la intoxicación por glicol de etileno se reportan alteraciones en los nervios craneales. El edema de la retina puede ser un signo de intoxicación por metanol (alcohol metílico). La acidosis metabólica crónica conduce a la osteoporosis y puede causar fracturas.
Diagnóstico
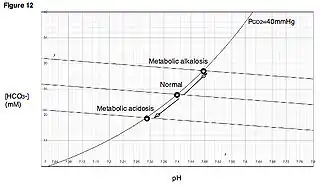
Hay tres abordajes para el estudio del equilibrio ácido/base: un enfoque cualitativo basado en la ecuación de Henderson/Hasselbach, un enfoque semicualitativos basado en el exceso de básico, y la teoría del «ion fuerte».
Ecuación de Henderson-Hasselbalch
La ecuación de Henderson Hasselbach, describe la relación entre pH de la sangre y los componentes del sistema de amortiguamiento químico H2CO3. Esta descripción cualitativa de la fisiología ácido/base permite separar el componente metabólico de los componentes de las vías respiratorias del equilibrio ácido-base.
El bicarbonato (HCO3) está en equilibrio con los componentes metabólicos, el bicarbonato producido en el riñón y el ácido de producción de fuentes endógenas o exógenas.
El ácido carbónico (H2CO3) está en equilibrio con el componente respiratorio, como lo demuestra la siguiente ecuación:
Exceso de base
Desafortunadamente, la ecuación de Henderson-Hasselbach no es lineal; la pCO2 ajusta al pH como parte de la compensación respiratoria normal de un trastorno ácido-base. Esta no linealidad de la ecuación de Henderson-Hasselbalch evita que la ecuación pueda cuantificar la cantidad exacta del déficit de bicarbonato en una acidosis metabólica. Esta observación dio lugar a la elaboración de un enfoque semicuantitativo, el exceso de base (EB).
El propósito de la ecuación del exceso de base es dar una cantidad cuantitativa de bicarbonato (mmol) necesarias para restarle o añadirle a 1 litro de sangre con el fin de restaurar un pH de 7,4 a niveles de pCO2 de 40 mmHg. Para estandarizar la hemoglobina, se desarrolló la fórmula del exceso de base estandarizada (SBE), para dar una mayor precisión in vivo:
Teoría del ion fuerte
Las descripciones clásicas de la fisiología ácido/base a menudo no podían explicar las realidades ácido/base de algunos pacientes críticamente enfermos. Ocasionalmente se veía una alcalosis en pacientes críticos que presentaban niveles de albúmina sérica disminuidos, y que eran valores que no pudieron ser cuantificados dentro de la ecuación de Henderson-Hasselbalch ni la de EB. Además, la acidosis "dilucional", frecuente después de una gran infusión de solución salina normal, tampoco puede ser explicada por aquellos enfoques para el equilibrio ácido básico.
Tanto Henderson-Hasselbalch como el EB asume que los cationes (como el Ca2+, Mg2+) y aniones (Cl-, albúmina, PO4-) permanecen sin cambios en el plasma sanguíneo de un paciente con acidosis metabólica. Sin embargo, en pacientes en estado crítico, se sabe que estos iones están en un flujo dinámico. Durante los años 1980, Peter Stewart diseñó la teoría del ion Fuerte, utilizando química cuantitativa, el cual toma en cuenta las fluctuaciones de todos los iones disueltos en el plasma sanguíneo.
Referencias
- HIDALGO ACOSTA, Isabel V. et al. Acidosis metabólica: un reto para los intensivistas. Rev Cubana Pediatr [online]. 2005, vol.77, n.2 [citado 2010-08-02]. ISSN 0034-7531.
Biochemistry of exercise-induced metabolic acidosis, Am J Physiol Regul Integr Comp Physiol 287: R502–R516, 2004