Teoría del campo cristalino
La teoría de campo cristalino (TCC) es un modelo teórico que describe la estructura electrónica de aquellos compuestos de los metales de transición que pueden ser considerados compuestos de coordinación. La teoría de campo cristalino explica exitosamente algunas de las propiedades magnéticas, colores, entalpías de hidratación y estructuras de espinela (octaédrica) de los complejos de los metales de transición, pero no acierta a describir las causas del enlace. La TCC fue desarrollada por los físicos Hans Bethe y John Hasbrouck van Vleck[1] en la década de 1930. La TCC fue posteriormente combinada con la teoría de orbitales moleculares para producir la teoría del campo de ligandos que aunque resulta un poco más compleja también es más ajustada a la realidad, ya que se adentra además en la explicación del proceso de formación del enlace químico en los complejos metálicos.
Un vistazo al análisis por TCC
De acuerdo a la TCC, la interacción entre un metal de transición y un grupo de ligandos deriva de la atracción entre el catión metálico positivamente cargado y la carga negativa de los pares de electrones no enlazantes de los ligandos. La teoría fue desarrollada bajo la suposición de que estos electrones no enlazantes de los ligandos producían repulsiones sobre los electrones de los orbitales d del catión central que terminaban por deformar los cinco orbitales d degenerados (esto significa de iguales energías) del catión, alterando sus energías.
Un orbital deformado posee mayor energía que un orbital nativo. Si se considera un campo repulsivo perfectamente esférico los cinco orbitales d deberían deformarse en la misma proporción y por lo tanto continuarían siendo degenerados, pero la TCC parte de la suposición de que los ligandos son cargas repulsivas puntuales, ubicadas en posiciones específicas del espacio, por lo tanto las repulsiones sobre los electrones de los orbitales d resultan asimétricas, lo que produce asimetrías en la manera en que deforman los orbitales causando que los cinco orbitales d de iguales energías (degenerados) se separen en varios grupos de diferente energía.
Esta separación se encuentra afectada por los siguientes factores:
- La naturaleza del ion metálico.
- El estado de oxidación del metal.
- El arreglo geométrico de los ligandos en torno al ion metálico.
- La naturaleza de los ligandos que rodean al ion metálico -a mayor efecto del ligando, mayor diferencia entre los grupos de baja y alta energía de orbitales d.
El tipo de complejo más común entre los metales de transición es el octaédrico; en este tipo de complejos seis ligandos se ubican en los vértices de un octaedro en torno al ion metálico.
Si suponemos que estos seis ligandos puntuales se ubican sobre los seis ejes de un sistema cartesiano tridimensional con el ion metálico en el origen de coordenadas y observamos la figura con la forma de los orbitales d, estamos en condiciones de comenzar a analizar la teoría del campo cristalino:
En esta disposición octaédrica los orbitales que resultan más gravemente deformados son los que poseen componentes mayoritarias sobre los ejes x, y, z. Observando el gráfico de orbitales d se puede notar que estos orbitales son el dz2 y el dx2-y2, mientras que los orbitales dxy, dxz y dyz reciben una interferencia mucho menor, esto causa que los orbitales d originalmente degenerados se separen en dos grupos con una diferencia de energía que se suele llamar Δoct. Aquí los dz2 y dx2-y2 forman el grupo de mayor energía eg y los dxy, dxz y dyz forman el grupo de menor energía t2g

Los compuestos tetraédricos son los segundos más comunes; en estos se considera que cuatro ligandos se acercan al ion metálico central desde los vértices de un tetraedro. Bajo un campo repulsivo tetraédrico los orbitales d se separan nuevamente en dos grupos con una diferencia de energía que se suele llamar Δtet, sin embargo al disponer estos cuatro ligandos lo más alejados uno del otro que resulte posible (no olvidar que los ligandos se repelen también entre sí), se nota que quedan en posiciones "entre" los ejes x, y, z. Por lo que las mayores repulsiones las recibirán los orbitales que posean componentes mayoritarias "entre" los ejes. Al observar el gráfico se puede ver que esos orbitales son los dxy, dxz y dyz formando el grupo de mayor energía, mientras que dz2 y dx2-y2 forman el grupo de menor energía, por lo que la situación resulta a la inversa que en un campo octaédrico. Además debido a que los electrones de los ligandos en el complejo tetraédrico no se encuentran directamente orientados hacia los orbitales d del ion metálico central, la separación entre orbitales de alta y baja energía resulta menor que en el caso de los octaédricos.
También se puede explicar de esta manera con la TCC la estructura electrónica de los complejos cuadrados planos y de complejos con otras geometrías.
La magnitud de la brecha Δ (delta) entre dos o más grupos de orbitales depende de varios factores, incluyendo la naturaleza de los ligandos y la geometría del complejo. Algunos ligandos solo producen un pequeño valor de Δ, mientras que otros generan una gran separación. Las razones subyacentes a esto pueden ser explicadas por la teoría del campo de ligandos. La serie espectroquímica es una lista de "fuerza de ligandos" obtenida empíricamente en base al grado de separación Δ que producen. De pequeño Δ a gran Δ son:
I− < Br− < S2− < SCN− < Cl− < NO3− < N3- < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < bipy < phen < NO2− < PPh3 < CN− < CO
El estado de oxidación del metal también contribuye con el grado de separación entre niveles de alta y baja energía. A medida que se incrementa el estado de oxidación para un determinado metal, el grado de separación Δ también aumenta. Por ejemplo un complejo de V3+ tendrá una mayor Δ que uno de V2+ para el mismo grupo de ligandos, Esto se puede explicar con facilidad, debido a que la nube electrónica de los cationes disminuye con el aumento de carga (porque de hecho pierden electrones) los ligandos se pueden aproximar mucho más a un ion V3+ que a uno V2+, la menor distancia entre ion y ligandos causa una mayor Δ ya que los electrones de ligandos y metal se encuentran más cercanos entre sí y por lo tanto se repelen más (se produce una mayor deformación de los orbitales d).
Configuraciones de alto espín y bajo espín
En inglés la palabra "spin" significa literalmente "giro" como el giro de un trompo sobre sí mismo, al hablar de orbitales atómicos o moleculares la palabra spin, castellanizada como espín hace referencia al cuarto número cuántico de los electrones, el número de momento angular intrínseco que brinda la noción de cómo "gira" un electrón sobre su eje. Ya que, como lo indica el principio de exclusión de Pauli, ningún electrón en un átomo puede tener sus cuatro números cuánticos iguales a otro cuando dos electrones ocupan un mismo orbital (es decir, ya tienen sus primeros tres números cuánticos iguales) deben hacerlo de modo que su cuarto número cuántico sea diferente, para el electrón solo existen dos estados cuánticos de espín posibles: -1/2 y +1/2, que comúnmente se llaman "espines opuestos"). Sin embargo existe, además, un cierto grado de repulsión entre electrones que ocupan un mismo orbital. Este grado de repulsión causa lo que se denomina energía de apareamiento, que es la energía que hay que entregarle a un electrón para que ocupe un orbital que ya se encuentra semilleno. Es por esto que un electrón, cuando tiene la posibilidad de optar entre varios orbitales degenerados (con la misma energía), tratará siempre de ocupar el mayor número posible de orbitales vacíos antes de empezar a completar orbitales semillenos. Esto que se conoce como regla de Hund es la base en la que se sustentan las propiedades magnéticas y algunas de las propiedades ópticas de los complejos.
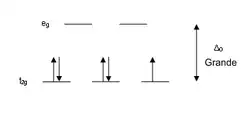
Los ligandos que causan una gran separación Δ en los orbitales atómicos d del metal se suelen referir como ligandos de campo fuerte, tales como por ejemplo el CN− y CO de la serie espectroquímica. En complejos formados por estos ligandos la separación en energía Δ entre el grupo de orbitales de mayor y menor energía resulta mayor que la energía de apareamiento de los electrones, esto causa que los orbitales de menor energía se completen, aún a costa del apareamiento de electrones, antes de comenzar a completar los de mayor energía (ocurre según el principio de Aufbau) este tipo de compuestos son llamados de "bajo espín", porque en ellos la suma de los momentos magnéticos causados por los electrones es la mínima posible. Por ejemplo, el NO2− es un ligando de campo fuerte y produce una gran Δ. El ion octaédrico Fe(NO2)6]3− que posee 5 electrones d, muestra un diagrama de campo octaédrico donde todos los electrones se encuentran en el nivel t2g, este ion es por lo tanto un complejo de espín bajo.
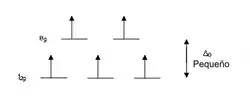
Por el contrario, ligandos como el I− y Br−, que causan un pequeño grado de separación Δ entre orbitales d son llamados "ligandos de campo débil". En estos complejos resulta energéticamente más rentable para los electrones ocupar todos los orbitales siguiendo la regla de Hund, es decir haciéndolo con espines desapareados. Esto ocurre así porque la energía de apareamiento es mayor que la separación Δ entre orbitales de baja y alta energía. Un complejo de este tipo se dice que es de "alto espín" porque la suma de los momentos magnéticos de todos sus electrones es la máxima posible. Por ejemplo, Br− es un ligando de campo débil y produce una Δoct pequeña. De modo que el ion [FeBr6]3−, que también posee cinco electrones d, muestra un diagrama de campo octaédrico con los cinco orbitales semillenos. Este ion por lo tanto es un complejo de espín alto.
Es decir que para que se forme un complejo de bajo espín, el costo energético de colocar un electrón en un orbital semilleno tiene que ser menor que el costo de colocar a ese mismo electrón desapareado en un orbital de mayor energía. Por otro lado si el costo energético de colocar un electrón en un orbital semilleno es mayor que la separación entre orbitales de menor y mayor energía, entonces se forma un complejo de alto espín.
La brecha energética para un complejo metálico tetraédrico (con cuatro ligandos), Δtet es aproximadamente igual a 4/9 de Δoct. Esto significa que la energía requerida para aparear dos electrones en estos complejos es típicamente mayor que la energía requerida para colocar electrones en orbitales de alta energía. Por lo tanto, los complejos tetraédricos son, usualmente, de espín alto.
La utilización de estos diagramas de separación energética puede ayudar en la predicción de las propiedades magnéticas de los compuestos de coordinación. Un compuesto que en su diagrama de separación energética muestra electrones con espines desapareados será paramagnético y se verá atraído por los campos magnéticos, mientras que un compuesto que no posea electrones desapareados en su diagrama energético será diamagnético y se verá débilmente repelido por los campos magnéticos.
Energía de estabilización de campo cristalino
La energía de estabilización de campo cristalino (EECC) es la estabilidad comparativa que resulta de colocar un ion de un metal de transición en un campo cristalino generado por un grupo de ligandos, en relación con colocar a ese mismo ion en un campo esférico. Esto se deduce del hecho de que, cuando los orbitales atómicos d se separan energéticamente en el campo formado por un grupo de ligandos, algunos de ellos terminan con una energía menor que la que tendrían en un campo perfectamente esférico conocido como baricéntrico. En un campo baricéntrico los cinco orbitales d se encontrarían degenerados. Por ejemplo, en el caso octaédrico, el grupo t2g se convierte en un grupo de menor energía que los orbitales en el baricentro. Como consecuencia de esto, si un electrón cualquiera se encuentra ocupando uno de estos orbitales, el ion metálico es más estable en ese campo de ligandos con respecto al baricentro en una cantidad conocida como EECC. Por el contrario, los orbitales eg en el caso octaédrico son de mayor energía que en un campo baricéntrico, de modo que cualquier electrón en uno de estos orbitales reduce la EECC.

Si la separación entre los orbitales d en un campo octaédrico es Δoct, los tres orbitales t2g se encuentran estabilizados con respecto al baricentro en 2/5 de Δoct, y los orbitales eg se encuentran desestabilizados en 3/5 de Δoct. Como ejemplo podemos considerar dos configuraciones de electrones d5 mostradas anteriormente en esta misma página. El ejemplo de bajo espín (arriba) tiene cinco electrones en los orbitales t2g , de modo que la energía de estabilización de campo cristalino total es 5 x 2/5 Δoct = 2Δoct. En el ejemplo de alto espín (inferior) , la EECC es (3 x 2/5 Δoct) - (2 x 3/5 Δoct) = 0 - en este caso, la estabilización generada por los electrones en los orbitales inferiores es cancelada por el efecto desestabilizante de los electrones en los orbitales superiores.
La estabilización de campo cristalino es aplicable a los complejos de metales de transición con cualquier geometría, y es más permite predecir en cierto punto la geometría de los mismos con tanta precisión como la teoría de repulsión de pares de electrones de valencia. Es así que según esta teoría la razón por la cual tantos complejos d8 son cuadrados planos es el enorme grado de estabilización cristalina que esta geometría produce para este número de electrones.
Explicando el color de los complejos de transición
Los brillantes colores exhibidos por muchos compuestos de coordinación pueden ser explicados con facilidad por la TCC. Si los orbitales atómicos d de un catión central en un complejo dado se ven separados en dos grupos de energías diferentes como se describe más arriba, cuando esa molécula absorbe un fotón de luz visible, uno de sus electrones de un nivel de energía inferior absorbe la energía del fotón y "salta" hacia un nivel de mayor energía para formar un átomo en un estado momentáneamente excitado. La diferencia entre las energías del átomo entre su estado nativo o "basal" y su estado excitado es aproximadamente igual a la diferencia entre orbitales de menor y mayor energía (ver más adelante) y es igual a la energía transportada por el fotón. Como la diferencia de energía entre los dos niveles electrónicos es igual a la energía del fotón absorbido, es posible relacionar esta energía con la longitud de onda del fotón según:
Donde:
- es la constante de Planck
- es la frecuencia de la onda
- es la velocidad de la luz
- es la longitud de onda
Luego cada transición electrónica absorbe determinadas longitudes de onda de la luz. Si la transición absorbe longitudes de onda dentro del rango visible (420 a 750 nm), entonces el compuesto, al ser iluminado con luz blanca, se ve coloreado; y precisamente del color complementario al color absorbido.
Como se explica más arriba, ya que diferentes ligandos producen campos cristalinos de diferente fuerza, es posible observar diferentes colores. Para un metal dado, ligandos de campo débil producen complejos con una Δ pequeña, la cual absorbe luz de baja energía, frecuencia baja y longitud de onda larga. Por otro lado, ligandos de campo fuerte provocan una gran Δ, absorben luz de alta y por lo tanto de corta .
Los complejos de transición presentan brillantes colores debido a que las diferencias en las energías de sus orbitales d se encuentran en el orden de las energías transportadas por las ondas del espectro visible.
Sin embargo es bastante extraño que la energía del fotón absorbido se corresponda exactamente con la brecha Δ; ya que existen numerosos factores que también afectan la diferencia de energía entre el estado basal y los diferentes estados excitados, cosas tales como las repulsiones electrón-electrón y el efecto Jahn-Teller.
¿Que color es el que se observa?

Esta rueda de colores muestra en los radios opuestos de que color aparecerá un compuesto si sólo absorbe un único color en el espectro visible. Por ejemplo, si el compuesto absorbe la luz de color rojo, aparecerá de color verde.
λ absorbida versus color observado
400 nm Se absorbe violeta, se observa verde-amarillo (λ 560 nm)
450 nm Se absorbe azul, se observa amarillo (λ 600 nm)
490 nm Se absorbe verde-azul, se observa rojo (λ 620 nm)
570 nm Se absorbe verde-amarillo, se observa violeta (λ 410 nm)
580 nm Se absorbe amarillo, se observa azul oscuro (λ 430 nm)
600 nm Se absorbe naranja, se observa azul (λ 450 nm)
650 nm Se absorbe rojo, se observa verde (λ 520 nm)
Diagramas de separación de campo cristalino
| Coordinación | Imagen | Diagrama de energía |
|---|---|---|
| Octaédrica |  |  |
| Bipiramidal pentagonal |  |  |
| Antiprisma cuadrada |  | 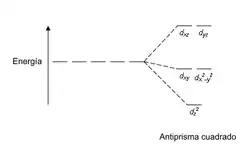 |
| Plano-cuadrada | 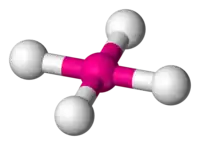 |  |
| Piramidal cuadrada |  |  |
| Tetraédrica |  | 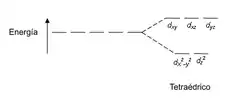 |
| Bipirámide trigonal |  | 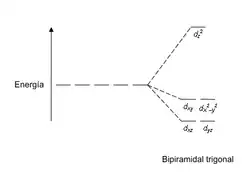 |
Galería
|
Véase también
Referencias
Bibliografía
- Zumdahl, Steven S. Chemical Principles Fifth Edition. Boston: Houghton Mifflin Company, 2005. 550-551,957-964.
- Silberberg, Martin S. Chemistry: The Molecular Nature of Matter and Change, Fourth Edition. New York: McGraw Hill Company, 2006. 1028-1034.
- D. F. Shriver and P. W. Atkins Inorganic Chemistry 3rd edition, Oxford University Press, 2001. Pages: 227-236.
- Housecroft, C. E. and Sharpe, A. G. (2005) Inorganic Chemistry 2nd edition, England: Pearson Education Limited. ISBN 0-13-039913-2
- Miessler, G. L. and Tarr, D. A. (2003) Inorganic Chemistry 3rd edition, New Jersey: Pearson Prentice Hall. ISBN 0-13-035471-6
