Cuerpo amigdalino
El cuerpo amigdalino, complejo amigdalino o amígdala cerebral es un conjunto de núcleos de neuronas localizadas en la profundidad de los lóbulos temporales de los vertebrados complejos, incluidos los humanos.[1] La amígdala forma parte del sistema límbico, y su papel principal es el procesamiento y almacenamiento de reacciones emocionales.[2][3]
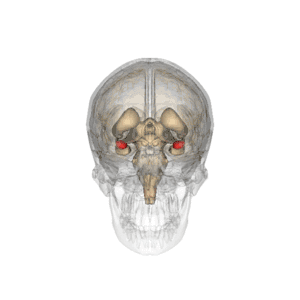
Divisiones anatómicas
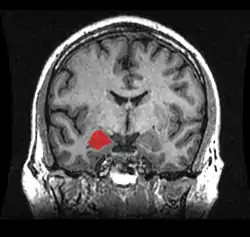
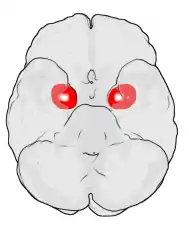
Las regiones descritas como «amígdala» en realidad abarcan una serie de núcleos con distintos atributos funcionales llamada complejo amigdalino. Entre esos núcleos se encuentra el grupo basolateral, el núcleo centromedial y el núcleo cortical. El grupo basolateral se puede dividir a su vez en el núcleo lateral, el basal y los núcleos basales accesorios.[2][4]
Conexiones
La amígdala envía proyecciones al hipotálamo, encargado de la activación del sistema nervioso autónomo, los núcleos reticulares para incrementar los reflejos de vigilancia, paralización y escape/huida, a los núcleos del nervio trigémino y facial para las expresiones de miedo, al área tegmental ventral, locus cerúleo, y núcleo tegmental laterodorsal para la activación de neurotransmisores de dopamina, glucocorticoides, noradrenalina y adrenalina (notar que muchos de estos neurotransmisores están estrechamente vinculados a las respuestas al estrés y en particular al distrés o estrés que es nocivo al organismo).[3][4]
El núcleo cortical está relacionado con el sentido del olfato y el procesamiento de las feromonas. Recibe información desde el bulbo olfatorio y la corteza olfatoria. El núcleo lateral, que envía proyecciones al resto del grupo basolateral y a los núcleos centromediales, recibe proyecciones desde sistemas sensoriales. Los núcleos centromediales conforman las principales sales para el grupo basolateral, y está involucrado en la activación emocional en ratas y gatos.[3][4][5]
Sexo y diferencias hemisféricas
Hay evidencias en muchas especies de que la amígdala está muy involucrada en la respuesta a las hormonas sexuales. La amígdala contiene receptores tanto para estrógenos como andrógenos y responde a fluctuaciones en los niveles hormonales mediante cambios en su morfología. La amígdala es mayor en varones adultos tanto en humanos como en muchos roedores y las hormonas parecen ser capaces de alterar muchas características de la amígdala, incluidas el número de neuronas y la expresión de sus neurotransmisores.
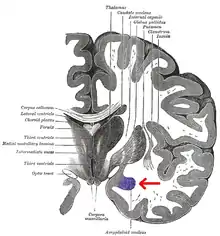
Además, resultados recientes sugieren que las diferencias sexuales en la amígdala podrían correlacionarse con diferencias hemisféricas de la amígdala. Cahill y otros[6] sugieren una teoría «derecha-varón, izquierda-mujer» de la actividad de la amígdala. Así, las conexiones con la amígdala derecha facilitan un mejor seguimiento o vigilancia de estímulos externos, y las conexiones con la amígdala izquierda facilitan un mejor seguimiento o vigilancia de estímulos internos.
Aprendizaje emocional
En vertebrados complejos, la amígdala se encarga principalmente de la formación y almacenamiento de memorias asociadas a sucesos emocionales. Investigaciones indican que, durante el condicionamiento del miedo, los estímulos sensoriales alcanzan el grupo basolateral de la amígdala, particularmente los núcleos laterales, donde se forman asociaciones con recuerdos del estímulo. La asociación entre el estímulo y eventos aversivos podrían ser mediados por potenciaciones a largo plazo, una prolongación de potencial en las estructuras sinápticas con el objetivo de reaccionar más fácilmente.[7]
Los recuerdos de experiencias emocionales que han dejado huella en conexiones sinápticas de los núcleos laterales inducen conductas asociadas con la emoción de miedo a través de conexiones con el núcleo central de la amígdala. El núcleo central está involucrado en el comienzo de las respuestas de miedo, incluida la paralización, taquicardia, incremento de la respiración y liberación de hormonas del estrés. Daños en la amígdala impiden tanto la adquisición como la expresión del condicionamiento de miedo, una forma de condicionamiento clásico de respuestas emocionales.[2][3]
La amígdala está también involucrada en el condicionamiento apetitivo. Parece ser que neuronas bien definidas responden a estímulos positivos y negativos, pero esas neuronas no están diferenciadas claramente en núcleos anatómicos.[8] Diferentes núcleos dentro de la amígdala tienen diferentes funciones en el condicionamiento apetitivo.[9]
Un modelo de aprendizaje emocional Pavloviano apetitivo se encuentra en los ratones, cuyas feromonas sexuales son atractivas de forma innata, mientras que los olores volátiles que desprenden no lo son hasta que adquieren esta propiedad por asociación con aquellas. Anatómicamente, las feromonas no volátiles estimulan el sistema vomeronasal, mientras que los volátiles asociados a ellas son detectados por el sistema olfativo. En el sistema del refuerzo, las feromonas no volátiles percibidas por primera vez activan el núcleo basolateral de la amígdala y el núcleo accumbens, pero no el área ventral tegmental ni la corteza prefrontal. El sistema del refuerzo se activa de forma diferente cuando los animales perciben olores volátiles que han adquirido la propiedad de atractivos por asociación con las feromonas. La detección de estos estímulos con valor atractivo adquirido estimula la actividad de la amígdala basolateral, del área ventral tegmental y de la corteza prefrontal, pero no del núcleo accumbens. La asociación entre las feromonas no volátiles y sus olores asociados se produce por tanto en el núcleo basolateral de la amígdala.[10]
Modulación de la memoria
La amígdala también está involucrada en la consolidación de la memoria. Después de cualquier evento de aprendizaje, la memoria a largo plazo para el estímulo no se forma de manera instantánea, sino que la información relacionada con ese evento es asimilada lentamente a través de una consolidación a largo plazo a lo largo del tiempo (la duración de la consolidación puede llegar a durar toda la vida), un proceso llamado consolidación de la memoria, hasta que alcanza un, relativamente, estado permanente.
Durante el periodo de consolidación, la memoria puede ser modulada. En particular, parece que la activación emocional después del evento de aprendizaje influye en la fuerza que tendrá la memoria posterior para ese evento. Una gran activación emocional posterior al evento enriquece la retención de información de una persona para ese evento. Experimentos han puesto de manifiesto que la administración de hormonas del estrés (catecolaminas y glucocorticoides) en ratones justo después de aprender algo aumenta su retención cuando se les presenta una prueba de recuerdo dos días después.
La amígdala, especialmente el grupo basolateral, está involucrada en mediar los efectos de la activación emocional en la fuerza de la huella mnemotécnica para el evento, como han mostrado muchos laboratorios, incluido el del profesor James McGaugh. Estos laboratorios han entrenado animales en varias tareas de aprendizaje y han encontrado que la inyección de drogas en la amígdala después de la sesión de entrenamiento afectan al recuerdo posterior de la tarea. Estas tareas incluyen condicionamiento clásico básico, como por ejemplo la evitación inhibitoria, en donde las ratas aprenden a asociar una suave descarga en las patas con un compartimento particular del aparato, y tareas más complejas, como laberintos de agua para orientación espacial o mediante pistas, donde la rata aprende a nadar hasta una plataforma para escapar del agua.[11] Si se inyecta en la amígdala una droga que inhibe su funcionamiento, los animales no pueden ejecutar la tarea con normalidad.
A pesar de la importancia de la amígdala en la modulación de la formación de la huella de memoria, sin embargo, el aprendizaje se puede producir sin su intervención, aunque ese aprendizaje parece tener déficits, como déficits en el condicionamiento de miedo que siguen a una lesión amigdalar.[12]
Investigaciones con humanos muestran que la amígdala juega un papel similar. La actividad de la amígdala a la hora de codificar información se asocia con la retención de información. Sin embargo, esta correlación depende de la «emocionalidad relativa» de los sucesos. Así, eventos más emocionalmente activantes (emotionally-arousing information) incrementan la actividad de la amígdala, y esa actividad correlaciona con la retención de información.[3]
Correlatos neuropsicológicos de la actividad amigdalina
Desde el punto de vista funcional la amígdala participa en la integración de la variada información sensorial con la esfera autonómica corporal y endocrina, que se traduce en respuestas de autoconservación en las esferas sexual, alimentaria, de agresividad y, en definitiva, con el comportamiento emocional.
La investigación en primates ha aportado explicaciones acerca de las funciones de la amígdala, así como una base para investigación futura. En 1888, se observó que monos rhesus con una lesión en el lóbulo temporal (incluida la amígdala) tenían déficits emocionales y sociales significativos.[13] Heinrich Klüver y Paul Bucy más tarde desarrollaron esta misma información tras mostrar que amplias lesiones en el lóbulo temporal anterior producían notables cambios, incluida una inapropiada violencia a objetos, hipoemocionalidad, pérdida de miedo, hipersexualidad, e incremento de la oralidad (hiperoralidad), que consiste en tomar y situar objetos inapropiados en la boca. Algunos monos también mostraban una incapacidad para reconocer objetos familiares y aproximación de forma indiscriminada tanto a objetos animados como inanimados, exhibiendo pérdida de miedo a lo largo de los experimentos. Este trastorno se denominó más tarde síndrome de Klüver-Bucy, de acuerdo con sus descubridores.[3][14] Estudios posteriores enfocaron su investigación en la amígdala de forma específica, ya que el lóbulo temporal comprende un amplio conjunto de estructuras cerebrales, que hacen difícil averiguar la función específica de una estructura concreta en relación con ciertos síntomas. Las madres cuyas amígdalas estaban dañadas mostraban una reducción de las conductas maternales hacia sus hijos, a menudo abusando físicamente de ellos y descuidándolos.[15] En 1981, investigadores hallaron que un conjunto de lesiones específicas que comprendían la amígdala completa causaban el síndrome de Klüver-Bucy.[16]
Con los avances en las técnicas de neuroimagen, como por ejemplo la tomografía por emisión de positrones o la resonancia magnética funcional, los neurocientíficos han hecho grandes averiguaciones en torno a la amígdala en el cerebro humano. Datos consensuados demuestran que la amígdala tiene un papel importante en los estados mentales, y que está relacionada con muchos trastornos psicológicos. En 2006, investigadores observaron una hiperactividad en la amígdala cuando se mostraba a los pacientes caras amenazantes o se veían implicados en situaciones terroríficas. Pacientes con una fobia social más severa correlacionaban con una mayor activación de la amígdala.[17] De forma parecida, pacientes depresivos mostraron una hiperactividad de la amígdala izquierda cuando interpretaban emociones para todo tipo de caras, y especialmente con caras amenazantes. Esta hiperactividad se normalizó cuando a los pacientes se les prescribió un tratamiento con antidepresivos.[18] Por el contrario, se ha observado que la amígdala actúa de forma diferente en pacientes bipolares. Un estudio del 2003 halló que tanto pacientes adultos como adolescentes con trastorno bipolar tendían a tener un considerable menor tamaño de la amígdala y también menor volumen hipocampal.[19] Muchos estudios se han concentrado en tratar de averiguar la relación entre amígdala y autismo.[20]
Investigaciones recientes sugieren que algunos parásitos, en particular el toxoplasma, forman quistes en el cerebro, a menudo afectando la amígdala. Esto podría aportar pistas acerca de cómo parásitos específicos manipulan la conducta y contribuyen al desarrollo de algunos trastornos, incluida la paranoia.[21]
Cognición social
La amígdala procesa las reacciones a las violaciones del espacio personal, y estas reacciones están ausentes en personas en las que la amígdala está dañada bilateralmente.[22] Por otra parte, se ha encontrado que la amígdala se activa durante un escaneo iRMf (imagen por resonancia magnética funcional) cuando las personas observan que otros se encuentren físicamente cerca de ellos, la persona que está siendo escaneada sabe que un experimentador está cerca al lado del escáner.
El alcoholismo y el abuso del alcohol
La amígdala parece desempeñar un papel en el consumo excesivo de alcohol, siendo dañada por episodios repetidos de intoxicación y abstinencia. El alcoholismo se asocia con una atenuación de la activación en las redes del cerebro responsables del procesamiento emocional, incluyendo la amígdala. La proteína quinasa C-epsilon en la amígdala parece ser crítica para el desarrollo de la ingesta excesiva de etanol.[cita requerida]
Referencias
- University of Idaho College of Science (2004). «amygdala». Archivado desde el original el 31 de marzo de 2007. Consultado el 15 de marzo de 2007.
- Amunts K, Kedo O, Kindler M, Pieperhoff P, Mohlberg H, Shah N, Habel U, Schneider F, Zilles K (2005). «Cytoarchitectonic mapping of the human amygdala, hippocampal region and entorhinal cortex: intersubject variability and probability maps». Anat Embryol (Berl) 210 (5-6): 343-52. PMID 16208455.
- Eichenbaum, H (2003). Neurociencia cognitiva de la memoria. Ariel Neurociencia.
- Ben Best (2004). «The Amygdala and the Emotions». Consultado el 15 de marzo de 2007.
- Michael McDannald, Erin Kerfoot, Michela Gallagher, and Peter C. Holland, Johns Hopkins University (2005). «Amygdala central nucleus function is necessary for learning but not expression of conditioned visual orienting». Consultado el 15 de marzo de 2007.
- Cahill, L., Haier, R.J., White, N.S., Fallon, J., Kilpatrick, L., Lawrence, C., Potkin, S.G., and Alkire, M.T. 2001. Sex-related difference in amygdala activity during emotionally influenced of amygdala involvement in emotionally influenced memorymemory storage. Neurobiol. Learn. Mem. 75: 1–9. http://www.ncbi.nlm.nih.gov/pubmed/11124043
- Ressler, Kerry; Davis, Michael (mayo de 2003). «Genetics of Childhood Disorders: L. Learning and Memory, Part 3: Fear Conditioning». J Am Acad Child Adolesc Psychiatry 42 (5): 612-615.
- Paton, Joseph; et Al. (25 de noviembre de 2005). «The primate amygdala represents the positive and negative value of visual stimuli during learning». Nature 439: 865-870. doi:10.1038/nature04490.
- See recent TINS article by Balleine and Killcross (2006)
- Jose Moncho-Bogani, Fernando Martínez-García, Amparo Novejarque, Enrique Lanuza. «Attraction to sexual pheromones and associated odorants in female mice involves activation of the reward system and basolateral amygdala.». European Journal of Neuroscience. Apr, 21(8) (2005) 2186 - 2198.
- Ferry B, Roozendaal B, McGaugh J (1999). «Role of norepinephrine in mediating stress hormone regulation of long-term memory storage: a critical involvement of the amygdala». Biol Psychiatry 46 (9): 1140-1152. PMID 10560021.
- Killcross S, Robbins T, Everitt B (1997). «Different types of fear-conditioned behaviour mediated by separate nuclei within amygdala». Nature 388 (6640): 377-380. PMID 9237754.
- Brown, S. & Shafer, E. (1888). «An investigation into the functions of the occipital and temporal lobes of the monkey's brain.». Philosophical Transactions of the Royal Society of London: Biological Sciences 179: 303-327.
- Kluver, H. & Bucy, P. (1939). «Preliminary analysis of function of the temporal lobe in monkeys.». Archives of Neurology 42: 979-1000.
- Bucher, K., Myersn, R., Southwick, C. (1970). «Anterior temporal cortex and maternal behaviour in monkey.». Neurology 20: 415.
- Aggleton, JP. & Passingham, RE. (1981). «Syndrome produced by lesions of the amygdala in monkeys (Macaca mulatta).». Journal of Comparative and Physiological Psychology 95: 961-977.
- Studying Brain Activity Could Aid Diagnosis Of Social Phobia. Monash University. 19 de enero de 2006.
- Sheline et al. (2001). «Increased amygdala response to masked emotional faces in depressed subjects resolves with antidepressant treatment: an fMRI study.». Biological Psychiatry 50 (9): 651-658.
- Blumberg et al. (2003). «Amygdala and hippocampal volumes in adolescents and adults with bipolar disorder». Arch Gen Psychiatry 60 (12): 1201-1208. PMID 14662552.
- Schultz RT (2005). «Developmental deficits in social perception in autism: the role of the amygdala and fusiform face area». Int J Dev Neurosci 23 (2-3): 125-141. PMID 15749240. doi:10.1016/j.ijdevneu.2004.12.012.
- Vyas et al. (2007). «Behavioral changes induced by Toxoplasma infection of rodents are highly specific to aversion of cat odors». Proc Natl Acad Sci U S A. 104 (15): 6442-6447. PMID 17404235.
- Manuel Ansede (16 de diciembre de 2010). «Juana sin miedo. Científicos de EE. UU. describen el caso de una mujer incapaz de sentir temor por una lesión cerebral.». (España): Público.es. Archivado desde el original el 18 de diciembre de 2010. Consultado el 28 de septiembre de 2017.