Ánodo
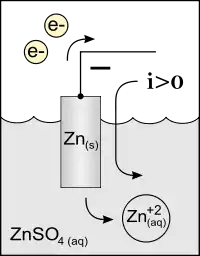
El ánodo es un electrodo en el que se produce una reacción de oxidación, mediante la cual un material, al perder electrones, incrementa su estado de oxidación.

Etimología
Faraday (en la serie VII de las Investigaciones experimentales sobre la electricidad) utilizó por primera vez el término, con el significado de «camino ascendente» o «de jugar o entrada» [del griego ανά (aná): hacia arriba, y οδός (odós): camino], pero referido exclusivamente al electrolito de una celda electroquímica.
Su vinculación al polo positivo del correspondiente generador implica tránsito de la corriente eléctrica por el circuito exterior desde el polo positivo hasta el negativo; es decir, transportada por cargas positivas.
| Celda galvánica | Celda electrolítica | |
|---|---|---|
| Tipo de conversión | Energía química → Energía eléctrica | Energía eléctrica → Energía química |
| Electrodo positivo | Cátodo (reducción) | Ánodo (oxidación). |
| Electrodo negativo | Ánodo (oxidación) | Cátodo (reducción) |
|
La polaridad del ánodo, positiva o negativa, depende del tipo de dispositivo y, a veces, del modo como opera, pues se establece según la dirección de la corriente eléctrica, atendiendo la definición universal de este fenómeno. En consecuencia:
|
Parecería lógico definir el sentido de la corriente eléctrica como el sentido del movimiento de las cargas libres. Sin embargo, si el conductor no es metálico, también hay cargas positivas en movimiento por el conductor externo (el electrolito de la celda), y cualquiera que sea el sentido convenido existirían cargas moviéndose en sentidos opuestos. Por tanto se adopta el convenio de que su definición del sentido de la corriente sea «el recorrido por las cargas positivas (cationes), y que en consecuencia es del positivo al negativo: ánodo → cátodo».
En los casos de válvulas termoiónicas, fuentes eléctricas, pilas, etcétera, el ánodo es el electrodo o terminal de menor potencial. En una reacción redox corresponde al elemento que se oxidará.
Válvulas termoiónicas
El ánodo de las válvulas termoiónicas recibe la mayor parte de los electrones emitidos por el cátodo. Cuando se trata de tubos amplificadores (triodos, tetrodos o pentodos) y sobre todo si son válvulas de potencia, este electrodo genera el calor que ocurre en el tubo, el cual se debe disipar. Para ello existen dos procedimientos, según los casos de:
- Gran potencia. El ánodo se acopla térmicamente a un disipador en el exterior de la válvula, que se refrigera mediante circulación de aire, vapor, aceite, etcétera.
- Menor potencia. En este caso los ánodos son grandes, con amplia superficie hacia el exterior, de modo que disipan por radiación.
El origen de este calor está en la energía que adquieren los electrones al ser sometidos a la diferencia de tensión entre ambos electrodos. Al impactar contra el ánodo ceden a este su energía, que se disipa por calor.
Ánodos especiales
Ciertas válvulas contienen ánodos especiales, como en el caso de los tubos de rayos X (tubo Röntgen). Los rayos X se generan al incidir electrones de gran energía contra los átomos del ánodo, comúnmente de wolframio o de molibdeno. La energía de estos electrones, además de emitirse en forma de rayos X, calienta enormemente al ánodo. Por ello se le provee de disipadores, por aire, aceite o por agua. Suelen ser rotatorios, con un motor que los impulsa para repartir la incidencia de los electrones por una superficie vasta.
En los tubos de rayos catódicos el ánodo envuelve la pantalla. Está conectado a ella por una fina capa de aluminio depositada sobre el tubo.
El ánodo de los magnetrones suele adoptar forma de cavidades resonantes a la frecuencia de funcionamiento.
En algunos acumuladores de agua caliente o fluido caloportador para placas solares de solar térmica, se instala un ánodo de sacrificio en el acumulador cuando no se dispone de anodización eléctrica. Esto se emplea para obligar al ánodo de sacrificio a corroerse a expensas de los demás elementos (protección catódica), para permitir a los equipos soportar la pila galvánica que efectúa el sistema en sus condiciones de funcionamiento (metales y compuestos de elementos de diferente conductividad, en agua con fluctuaciones de temperatura). Esto es una parte muy importante en el mantenimiento preventivo y fomenta la durabilidad de los equipos y del sistema, ya que esta misma corrosión anódica también acrecienta la deposición de cal (y otras sales presentes en el agua) en el circuito.