Anticuerpo neutralizante
Un anticuerpo neutralizante (NAb) es un anticuerpo que defiende una célula de un patógeno o partícula infecciosa neutralizando cualquier efecto que tenga biológicamente. La neutralización hace que la partícula ya no sea infecciosa o patógena.[1] Los anticuerpos neutralizantes son parte de la respuesta humoral del sistema inmune adaptativo contra virus, bacterias intracelulares y toxina microbiana. Al unirse específicamente a las estructuras superficiales (antígeno) en una partícula infecciosa, los anticuerpos neutralizantes evitan que la partícula interactúe con sus células huésped que podría infectar y destruir. La inmunidad debida a anticuerpos neutralizantes también se conoce como inmunidad esterilizante, ya que el sistema inmunitario eliminó la partícula infecciosa antes de que ocurriera cualquier infección.[2]
| Anticuerpo neutralizante | ||
|---|---|---|
| Tipo | grupo o clase de proteínas | |
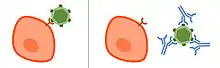
Mecanismo
Para ingresar a las células, las partículas de virus y las bacterias intracelulares usan moléculas en sus superficies para interactuar con los receptores de la superficie celular de su célula objetivo, lo que les permite ingresar a la célula y comenzar su ciclo de replicación.[3] Los anticuerpos neutralizantes pueden inhibir la infectividad al unirse al patógeno y bloquear las moléculas necesarias para la entrada celular.Esto puede deberse a que los anticuerpos interfieren estáticamente con los patógenos o toxinas que se unen a los receptores de la célula huésped. En caso de una infección viral, los NAb pueden unirse a las glucoproteínas de los virus con envoltura o las proteínas de la cápside de los virus sin envoltura. Además, los anticuerpos neutralizantes pueden actuar evitando que las partículas experimenten cambios estructurales que a menudo se necesitan para una entrada celular exitosa. Por ejemplo, los anticuerpos neutralizantes pueden prevenir los cambios conformacionales de las proteínas virales que median la fusión de la membrana necesaria para ingresar a la célula huésped.En algunos casos,[3] el virus no puede infectar incluso después de que el anticuerpo se disocia. El complejo patógeno-anticuerpo eventualmente es absorbido y degradado por los macrófagos.[4]
Los anticuerpos neutralizantes también son importantes para neutralizar los efectos tóxicos de las toxinas bacterianas. Un ejemplo de un anticuerpo neutralizante es la antitoxina diftérica, que puede neutralizar los efectos biológicos de la toxina diftérica.Los anticuerpos neutralizantes no son efectivos contra las bacterias extracelulares, ya que la unión de los anticuerpos no impide que las bacterias se repliquen. Aquí, el sistema inmune utiliza otras funciones de los anticuerpos, como la opsonización y la activación del complemento, para matar las bacterias.
Diferencia entre anticuerpos neutralizantes y anticuerpos de unión
No todos los anticuerpos que se unen a una partícula patogénica son neutralizantes. Los anticuerpos no neutralizantes, o anticuerpos de unión, se unen específicamente al patógeno, pero no interfieren con su infectividad. Eso podría deberse a que no se unen a la región correcta. Los anticuerpos no neutralizantes pueden ser importantes para marcar la partícula en busca de células inmunes, lo que indica que ha sido dirigida, después de lo cual la partícula es procesada y, en consecuencia, destruida por las células inmunes reclutadas. Por otro lado, los anticuerpos neutralizantes pueden neutralizar los efectos biológicos del antígeno sin necesidad de células inmunes. En algunos casos, algunas especies de virus pueden utilizar anticuerpos no neutralizantes o cantidades insuficientes de anticuerpos neutralizantes que se unen a partículas de virus para facilitar la absorción en sus células huésped. Este mecanismo se conoce como mejora dependiente de anticuerpos.Se ha observado para el virus del dengue y el virus Zika.
Producción
Los anticuerpos son producidos y secretados por los Linfocito B. Cuando se producen células B en la médula ósea, los genes que codifican los anticuerpos se someten a una recombinación genética aleatoria (recombinación V (D) J), lo que da como resultado que cada célula B madura produzca anticuerpos que difieren en su secuencia de aminoácidos en la unión al antígeno región. Por lo tanto, cada célula B produce anticuerpos que se unen específicamente a diferentes antígenos. Una gran diversidad en el repertorio de anticuerpos permite que el sistema inmune reconozca una gran cantidad de patógenos que pueden presentarse en diferentes formas y tamaños. Durante una infección solo se producen anticuerpos que se unen al antígeno patógeno con alta afinidad. Esto se logra mediante la selección clonal de un solo clon de células B: las células B se reclutan en el sitio de la infección mediante la detección de interferones que son liberados por las células infectadas como parte de la respuesta inmune innata. Las células B muestran receptores de células B en su superficie celular, que es solo el anticuerpo anclado a la membrana celular. Cuando el receptor de células B se une a su antígeno afín con alta afinidad, se activa una cascada de señalización intracelular. Además de unirse a un antígeno, las células B deben ser estimuladas por las citocinas producidas por las células T auxiliares como parte de la respuesta celular del sistema inmune contra el patógeno. Una vez que una célula B está completamente activada, prolifera rápidamente y se diferencia en células plasmáticas. Las células plasmáticas segregan el anticuerpo antígeno específico en grandes cantidades.Después de un primer encuentro del antígeno por vacunación o infección natural, la memoria inmunológica permite una producción más rápida de anticuerpos neutralizantes después de la próxima exposición al virus.
Evasión de virus de anticuerpos neutralizantes
Los virus usan una variedad de mecanismos para evadir los anticuerpos neutralizantes. Los genomas virales mutan a gran velocidad. Se seleccionarán las mutaciones que permiten que los virus evadan un anticuerpo neutralizante y, por lo tanto, prevalecerán. Por el contrario, los anticuerpos también evolucionan simultáneamente por maduración por afinidad durante el curso de una respuesta inmune, mejorando así el reconocimiento de partículas virales. Las partes conservadas de proteínas virales que juegan un papel central en la función viral tienen menos probabilidades de evolucionar con el tiempo y, por lo tanto, son más vulnerables a la unión de anticuerpos. Sin embargo, los virus han desarrollado ciertos mecanismos para el acceso estérico de un anticuerpo a estas regiones, lo que dificulta la unión. Los virus con una baja densidad de proteínas estructurales superficiales son más difíciles de unir a los anticuerpos. Algunas glicoproteínas virales están fuertemente glicosiladas por los glicanos unidos a N y O, creando un denominado escudo de glicanos, que puede disminuir la afinidad de unión de los anticuerpos y facilitar la evasión de los anticuerpos neutralizantes. El VIH-1, la causa del SIDA humano, utiliza ambos mecanismos.
Usos médicos de los anticuerpos neutralizantes
Los anticuerpos neutralizantes se usan para la inmunización pasiva, y pueden usarse para pacientes incluso si no tienen un sistema inmunitario saludable. A principios del siglo XX, a los pacientes infectados se les inyectó antisuero, que es el suero sanguíneo de un paciente previamente infectado y recuperado que contiene anticuerpos policlonales contra el agente infeccioso. Esto demostró que los anticuerpos podrían usarse como un tratamiento efectivo para las infecciones virales y las toxinas. El antisuero es una terapia muy cruda, porque los anticuerpos en el plasma no están purificados o estandarizados y el donante podría rechazar el plasma sanguíneo. Como depende de la donación de pacientes recuperados, no se puede ampliar fácilmente. Sin embargo, la terapia con suero todavía se usa hoy como la primera línea de defensa durante un brote, ya que puede obtenerse relativamente rápido.Se demostró que la terapia con suero reduce la mortalidad en pacientes durante la pandemia de gripe porcina de 2009.Y la epidemia del virus del Ébola en África occidental.También se prueba como posible tratamiento para COVID-19.La terapia de inmunoglobulina, que utiliza una mezcla de anticuerpos obtenidos de personas sanas, se administra a pacientes inmunodeficientes o inmunodeprimidos para combatir infecciones. Para un tratamiento más específico y robusto se pueden usar anticuerpos policlonales o monoclonales purificados (mAb). Los anticuerpos policlonales son una colección de anticuerpos que se dirigen al mismo patógeno pero se unen a diferentes epítopos. Los anticuerpos policlonales se obtienen de donantes humanos o de animales que han sido expuestos al antígeno. El antígeno inyectado en los donantes animales puede diseñarse de tal manera que produzca preferiblemente anticuerpos neutralizantes.Los anticuerpos policlonales se han utilizado como tratamiento para el citomegalovirus (CMV), el virus de la hepatitis b (HBV), el virus de la rabia, el virus del sarampión y el virus sincitial respiratorio (RSV).La antitoxina de la difteria contiene anticuerpos policlonales contra la toxina de la difteria.Al tratar con anticuerpos que unen múltiples epítopos, el tratamiento sigue siendo efectivo incluso si el virus muta y uno de los epítopos cambia de estructura. Sin embargo, debido a la naturaleza de la producción, el tratamiento con anticuerpos policlonales sufre de variación de lote a lote y títulos bajos de anticuerpos.Los anticuerpos monoclonales, por otro lado, se unen al mismo epítopo con alta especificidad. Se pueden producir con la tecnología Hybridoma, que permite la producción de mAbs en grandes cantidades.Los mAb contra las infecciones dejan de funcionar cuando el virus muta el epítopo que está dirigido por los mAbs o cuando circulan cepas múltiples. Los ejemplos de medicamentos que usan anticuerpos monoclonales incluyen ZMapp contra el Ébola y Palivizumab contra el VSR.Muchos mAB contra otras infecciones se encuentran en ensayos clínicos. Los anticuerpos neutralizantes también juegan un papel en la inmunización activa por vacunación. Al comprender los sitios de unión y la estructura de los anticuerpos neutralizantes en una respuesta inmune natural, una vacuna puede diseñarse racionalmente de modo que estimule el sistema inmune para producir anticuerpos neutralizantes y no anticuerpos de unión.La introducción de una forma debilitada de un virus a través de la vacunación permite la producción de anticuerpos neutralizantes por las células B. Después de una segunda exposición, la respuesta de anticuerpos neutralizantes es más rápida debido a la existencia de células B de memoria que producen anticuerpos específicos para el virus.Una vacuna eficaz induce la producción de anticuerpos que pueden neutralizar la mayoría de las variantes de un virus, aunque la mutación del virus que resulta en la evasión de anticuerpos puede requerir la actualización de las vacunas en respuesta.Algunos virus evolucionan más rápido que otros, lo que puede requerir la necesidad de actualizar las vacunas en respuesta. Un ejemplo bien conocido es la vacuna contra el virus de la influenza, que debe actualizarse anualmente para tener en cuenta las cepas circulantes recientes del virus. Los anticuerpos neutralizantes también pueden ayudar al tratamiento de la esclerosis múltiple.Aunque este tipo de anticuerpo tiene la capacidad de combatir las infecciones retrovirales, en algunos casos ataca a los productos farmacéuticos administrados al cuerpo que de otro modo tratarían la esclerosis múltiple. Los fármacos proteicos recombinantes, especialmente los derivados de animales, son comúnmente atacados por anticuerpos neutralizantes.Algunos ejemplos son Rebif, Betaseron y Avonex.
Referencias
- «Neutralising antibody». Biology-Online. 2008. Consultado el 4 de julio de 2009.
- Dutta, A; Huang, CT; Lin, CY; Chen, TC; Lin, YC; Chang, CS; He, YC (6 de septiembre de 2016). «Sterilizing immunity to influenza virus infection requires local antigen-specific T cell response in the lungs.». Scientific Reports 6: 32973. Bibcode:2016NatSR...632973D. PMC 5011745. PMID 27596047. doi:10.1038/srep32973.
- Principles of Virology, Volume 1: Molecular Biology (4th edición). ASM Press. 2015. p. 31. ISBN 978-1555819330.
- Principles of Virology, Volume 2: Pathogenesis and Control (4th edición). ASM Press. 2015. p. 125. ISBN 978-1-555-81951-4.
Enlaces externos
- Esta obra contiene una traducción derivada de «Neutralizing antibody» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.