Antinocicepción
El término antinocicepción se refiere a la reversión o alteración de los aspectos sensoriales de la intensidad del dolor. La mayoría de los modelos para examinar la antinocicepción se desarrollaron para su uso en animales con el fin de explorar alteraciones en la sensibilidad a un estímulo doloroso después de la administración de un fármaco con posibles propiedades analgésicas (alivio del dolor). El término se usa generalmente para evitar la connotación antropomórfica del término analgesia, que significa estrictamente la reversión de la sensación subjetiva de dolor, cuya presencia solo puede inferirse en los animales.[1]
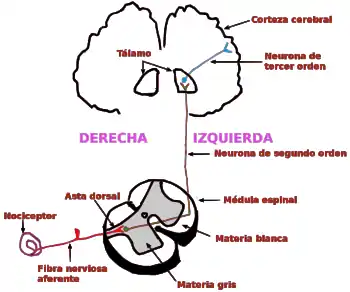
Antecedentes
Una de las funciones vitales del sistema nervioso es informar sobre la existencia o amenaza de una lesión. La sensación de dolor, por su naturaleza aversiva inherente, contribuye a esta función. El sistema nervioso periférico responde a estímulos nocivos (perjudiciales o potencialmente perjudiciales) y, por tanto, transmite una señal para alertar al organismo de una lesión potencial. Los investigadores han estudiado la sensibilidad cutánea mediante el registro de fibras nerviosas individuales en diferentes especies, como en el ser humano. Se aplican estímulos al campo receptivo (es decir, al área de tejido que responde al estímulo aplicado) de fibras individuales, y se anotan las características de la respuesta neural. Los receptores sensitivos de la piel se han estudiado de forma más extensa que los receptores de cualquier otro tejido.[2]
A los receptores nerviosos que responden a estímulos nocivos se les denominan nociceptores, de nocere, 'dañar', término acuñado por Sir Charles Scott Sherrington (1857-1952) en 1906.[3]
Pruebas antinociceptivas
Las pruebas antinociceptivas abarcan un gran grupo de procedimientos experimentales desarrollados específicamente para examinar la sensibilidad a los estímulos dolorosos y la alteración de la sensibilidad al dolor después de la administración de un fármaco. Dado que la mayoría de las pruebas antinociceptivas se han diseñado para examinar la sensibilidad al dolor en animales, la información que brindan es limitada con respecto de los aspectos afectivos de la percepción del dolor, como las molestias o los desagradables. Estas características tienen más probabilidades de ser examinadas en estudios con sujetos humanos.[4]
Se han desarrollado varios procedimientos para examinar las propiedades analgésicas de los fármacos en animales de laboratorio, por ejemplo en roedores. Cada uno de estos procedimientos implica ejercer un estímulo potencialmente doloroso (nociceptivo), seguido de la medición de una respuesta claramente observable.[5]
Existen diversos tipos de estímulos nociceptivos (eléctricos, térmicos, mecánicos o químicos) que se han utilizado en diferentes modelos de dolor; sin embargo, ninguno es ideal, aunque los estímulos químicos probablemente imitan más estrechamente el dolor clínico agudo.[6]
En general, las pruebas antinociceptivas para examinar el dolor agudo implican dar un breve estímulo térmico, mecánico o eléctrico a la piel, las patas o la cola de un animal. Uno de los procedimientos más comunes en esta categoría es el procedimiento de sacudida de cola, originalmente desarrollado por D'Amour y Smith en 1941.[7]
Por lo general, los datos que se obtienen se basan en el tiempo que le toma al organismo responder o apartarse de un estímulo nociceptivo. Una vez que los niveles iniciales de acción en respuesta al estímulo nociceptivo sean determinados y considerados confiables, se administra un fármaco y las latencias de respuesta se vuelven a determinar en presencia del fármaco. Si el tiempo que le toma al organismo responder al estímulo es más prolongado después de la administración del fármaco -y más importante-, si este cambio no se debe a que el animal no pueda responder debido a los efectos sedantes del medicamento, entonces se considera que el medicamento produce efectos antinociceptivos.[4] Por ejemplo, el péptido hormonal oxintomodulina, cuando es administrada por vía intratecal e intracerebroventricular (de 1 a 5 μg/5 μl) muestra un efecto antinociceptivo dependiente de la dosis medida en la prueba de contorsión (la prueba de antinocicepción) inducida por ácido acético. El tiempo de respuesta acumulativo de los comportamientos nociceptivos inducidos por la inyección de formalina intraplantar se redujo en ambas administraciones de oxintomodulina durante la segunda, pero no la primera fase.[8]
Ética del uso modelos de pruebas antinociceptivas
El estudio del dolor en animales despiertos plantea problemas éticos, filosóficos y técnicos. Filosóficamente, existe el problema de que el dolor no se puede controlar directamente en los animales, sino que solo se puede estimar mediante el examen de sus respuestas a los estímulos nociceptivos; ahora bien, tales respuestas no necesariamente significan que haya una sensación concomitante.[6]
La ausencia de comunicación verbal en animales es, sin duda, un obstáculo para la evaluación del dolor. Hay circunstancias durante las cuales puede haber pocas dudas de que un animal siente dolor, especialmente cuando responde a estímulos a través de respuestas vocales como chirridos o gemidos. Por otro lado, es mucho más difícil certificar que, en un momento dado, un animal no siente dolor porque no presenta signos físicos típicos ni conductas manifiestas.[6]
Al igual que con todas las investigaciones biomédicas con animales, la investigación del dolor presenta problemas éticos en dos niveles. Desde un punto de vista general, los investigadores deben seguir las recomendaciones de los comités de ética y, en particular, las de los consejos de revisión científica internacionales para garantizar un determinado nivel de bienestar fisiológico en el animal. De hecho, si el animal está en un estado de estrés en el que las reacciones neurovegetativas se ven exacerbadas, está claro que las observaciones científicas no serán válidas desde un punto de vista fisiológico. Por lo tanto, no es solo por razones morales sino también por razones científicas que se deben observar algunas reglas.[9]
El segundo punto es más específico para los estudios sobre el dolor. El comité de ética de la Asociación Internacional para el Estudio del Dolor (IASP, por sus siglas en inglés) ha formulado una serie de recomendaciones sobre este tema. En un preámbulo, el comité declaró que los experimentos son indispensables si queremos obtener una mejor comprensión de los mecanismos del dolor. Como en otras áreas de la investigación biomédica, las actitudes de los científicos están condicionadas por la forma en que consideran su tema de estudio: deben considerar al animal no como un objeto, sino como un ser vivo dotado de sensaciones. El comité, aunque reconoce que algunos experimentos tienen el objetivo de tratar de reproducir síndromes crónicos en animales, estableció claramente que los protocolos experimentales deben minimizar o evitar el dolor (esta noción podría, a priori, parecer paradójica, sin embargo, se puede estudiar la nocicepción sin producir dolor).[6]
Las otras recomendaciones del comité con respecto de los estudios del dolor agudo se pueden resumir como sigue:
- Los experimentos que involucran el estudio del dolor en animales conscientes deben ser revisados previamente por científicos y laicos, y se debe demostrar el beneficio potencial de estos experimentos;
- En la medida de lo posible, el científico debe probar los estímulos dolorosos en sí mismo, y esto debería aplicarse a la mayoría de los estímulos no invasivos;
- El científico debe evaluar cuidadosamente todos los cambios de comportamiento y fisiológicos en el animal e reportarlos en los manuscritos resultantes;
- Como en otras áreas de la neurociencia, no se debe cuestionar el uso de animales paralizados con un agente bloqueador neuromuscular sin anestesia general o un procedimiento quirúrgico apropiado que elimine la conciencia sensorial; y
- La duración de los experimentos debe ser lo más breve posible, y la cantidad de animales involucrados debe mantenerse al mínimo.[10]
Véase también
Referencias
- Stolerman, Ian P. (2010). Encyclopedia of Psychopharmacology (PDF) (en inglés) (Online-Ausg. edición). Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg. p. 108-112. ISBN 978-3-540-68706-1.
- Koltzenburg, Martin; McMahon, Stephen B. (2007). Wall y Melzack: Tratado del dolor (5a ed. edición). Madrid: Elsevier. p. 3. ISBN 978-84-8174-949-6.
- Sherrington, Charles S (1906). The integrative action of the nervous system. Nueva York: Scribner.
- Dykstra, Linda (2010). Stolerman, Ian P., ed. Encyclopedia of Psychopharmacology (Online-Ausg. edición). Berlin, Heidelberg: Springer-Verlag Berlin Heidelberg. pp. 108-112. ISBN 978-3-540-68706-1. Archivado desde el original el 4 de abril de 2018. Consultado el 3 de abril de 2018.
- Dimov, Luiz Fabio; Toniolo, Elaine Flamia; Alonso-Matielo, Heloísa; [Et al] (Noviembre de 2017). «Electrical stimulation of the insular cortex as a novel target for the relief of refractory pain: An experimental approach in rodents». Behavioural Brain Research 346: 86-95. doi:10.1016/j.bbr.2017.11.036. Consultado el 3 de abril de 2018.
- Le Bars, D; Gozariu, M; Cadden, SW (Diciembre de 2001). «Animal models of nociception.» (PDF (acceso público)). Pharmacological reviews 53 (4): 597-652. PMID 11734620.
- D'Amour, Fred E.; Smith, Donn L. (1941). «A method for determining loss of pain sensation». Journal of Pharmacology and Experimental Therapeutics 72 (1).
- Park, Soo-Hyun; Lee, Jae-Ryeong; Jang, Sang-Pil; [Et al] (Abril de 2018). «Antinociceptive profiles and mechanisms of centrally administered oxyntomodulin in various mouse pain models». Neuropeptides 68: 7-14. doi:10.1016/j.npep.2018.01.002.
- Morton, DB; Griffiths, PH (Abril de 1985). «Guidelines on the recognition of pain, distress and discomfort in experimental animals and an hypothesis for assessment.». The Veterinary record 116 (16): 431-436. doi:10.1136/vr.116.16.431.
- Zimmermann, M (Junio de 1983). «Ethical guidelines for investigations of experimental pain in conscious animals.». Pain 16 (2): 109-110. doi:10.1016/0304-3959(83)90201-4.