Azobenceno
El azobenceno es un compuesto químico compuesto de dos anillos fenilo unidos por un doble enlace N=N. Es el ejemplo más simple de un azoderivado. El término "azobenceno" o simplemente "azo" se usa a menudo para referirse a una amplia clase de moléculas que comparten la estructura de núcleo de azobenceno, con diferentes grupos funcionales químicos que se extienden desde los anillos de fenilo. Estos compuestos azoicos se consideran derivados del diazeno (diimida), y a veces se denominan diazenos. Los diazenos absorben la luz fuertemente y se utilizan como tintes en una variedad de industrias.[2]
| Azobenzeno | ||
|---|---|---|
-1%252C2-diphenyldiazene_200.svg.png.webp) Esqueleto de la fórmula del azobenzeno | ||
 Bolas 3D de Azobenzeno | ||
| Nombre IUPAC | ||
| (E)-Diphenyldiazene | ||
| General | ||
| Otros nombres | Azobenzeno | |
| Fórmula molecular | C1/C12H10N2/c1-3-7-11(8-4-1)13-14-12-9-5-2-6-10-12/h1-10H/b14-13+KDMLAVOWQYNRWNQ-BUHFOSPRBP | |
| Identificadores | ||
| Número CAS | 103-33-3[1] | |
| ChEBI | 190358 | |
| ChemSpider | 21159446 | |
| PubChem | 2272 | |
| Propiedades físicas | ||
| Masa molar | 182,2216 g/mol | |
Historia
El azobenceno fue descrito por vez primera por Eilhard Mitscherlich en 1834.[3][4] El azobenceno fue investigado en 1856 por Alfred Nobel como «gelblich-rote krystallinische Blättchen» ('cuchillas cristalinas amarillentas' en alemán).[5] La preparación original es similar a la moderna. Siguiendo el método de 1858, el nitrobenzeno es reducido por limalha de hierro en presencia del ácido acético[6] En la síntesis moderna, el zinc es el reductor en la presencia de una base, como descrito por Bigelow y Robinson, en modificación del método original de Alexejew.[7]
Ha sido preparado de muchas maneras diferentes, de las cuales son representativas las siguientes: puede ser obtenido por reducción de nitrobenzeno amalgama de sodio, con sulfatos alcalinos, con celulosa, molasses o dextrosa en solución alcalina, y por reducción catalítica.[7]
El azobenzeno también puede ser obtenido de la reducción de anilina diazotada con sales de cobre (I) (sales cuprosas).[7]
La anilina ha sido oxidada, resultando en azobenzeno, por aire y por permanganato de potasio.[7]
La condensación de nitrobenzeno y acetato de anilina también rinde como producto azobenzeno.[7]
Isomerización trans-cis
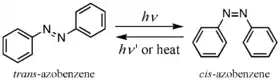
Una de las propiedades más intrigantes del azobenzeno (y sus derivados) es la fotoisomerización de los isomerios trans y cis. Los dos isomeros pueden pasar de uno para otro con particulares longitudes de onda de luz: luz ultravioleta, las cuales corresponden a la energía del laguna de la transición π-π* (estado S2), para conversión trans-la-cis, y luz azul, la cual es equivalente a la transición n-π* (estado S1), para somerización cis-la-trans. Por una variedad de razones, el isómero cis es menos estable que el trans (por ejemplo, tiene una configuración distorsionada y es menos acomodado - más "tenso" - del que la configuración trans). Entonces, el cis-azobenzeno irá a relajar térmicamente nuevamente al trans veía isomerizado cis-la-trans. El isómeto trans es más estable en aproximadamente 50 kJ/mol, y la barrera a la foto-isomerización es aproximadamente 200 kJ/mol.[8][9]
Clasificación espectroscópica
Las longitudes de onda en las cuales la isomerización del azobenzeno ocurre depende de la estructura particular de cada molécula de compuesto azo, que están típicamente agrupadas en tres clases: las moléculas del tipo azobenzeno, los aminoazobenzenos, y los pseudo-estilbenos. Estos compuestos azos son amarillos, anaranjados y rojos, respectivamente, debido a sutiles diferencias en sus espectros de absorción electrónica. Los compuestos similares a los compuestos de azobenzeno no sustituidos exhiben una baja densidad de absorción n-π* en la región del visible, y una densidad de absorción π-π* mucho más alta en la región de ultravioleta. Los compuestos azo que son orto- o para-sustituidos con grupos donantes de electrones (tales como los aminos), son clasificados como aminoazobenzenos, y tienden a presentar un pequeño espaciado en las bandas n-π* y π-π* en el visible. La clase pseudo-estilbeno está caracterizada por la sustitución de las posiciones 4 y 4' de los dos anillos azo con donantes de electrones y electrones que retiran de los grupos (es decir, las dos extremidades opuestas del sistema aromático son funcionalizadas). La adición de esta configuración "push-pull" resulta en una distribución electrónica fuertemente asimétrica, la cual modifica una serie de propiedades ópticas. En particular, ella desplaza el espectro de absorción de los isómeros trans y cis, de modo que ellos se solapan de forma eficaz. Así, para estos compuestos una única longitud de onda de luz en la región visible inducirá isomerización tanto para el cis como el trans. Bajo iluminación, estas moléculas quedan en ciclo entre los dos estados isoméricos.[9]
Fotofísica de la isomerización
La fotoisomerización del azobenzeno es extremadamente rápida, ocurriendo en la escala de picosegundos. La tasa del relajamiento de retorno térmico varía enormemente dependiendo del compuesto: usualmente horas para las moléculas del tipo del azobenzeno, minutos para aminoazobenzenos, y segundos para los pseudo-estilbenos.[9]
El mecanismo de isomerización ha sido objeto de algún debate, con dos caminos identificados como viables: una rotación sobre la conexión N-N, con ruptura de la conexión doble, o veía una inversión, con un estado de transición híbrido y semilineal. Ha sido sugerido que la conversión de trans-para-cis ocurre vía rotación en el estado S2, mientras la inversión ocurre en la conversión cis-para-trans. Está aún en discusión cual estado excitado desempeña un papel directo en la serie del comportamiento de fotoisomerização. Sin embargo, las más recientes investigaciones en espectroscopia de transición de femtosegundo han sugeridos que el estado S2 sufre conversión interna al estado S1, y entonces ocurre la isomerización trans-para-cis. Recientemente, un otro camino de isomerización fue propuesto por Diau, la vía de la "inversión concertada" en que ambos ángulos de conexión CNN se curvan a la vez.[10]
Movimientos fotoinducidos
La fotoisomerización del azobenzeno es una forma de movimiento molecular fotoinducido.[11] Esta isomerización puede también conducir a movimiento en mayores escalas de longitud. Por ejemplo, la luz polarizada hará que las moléculas se izomericen y relajen en posiciones aleatorias. Sin embargo, aquellas moléculas (trans) relajadas que se sitúan perpendicularmente a la polarización de la luz incidente, dejarán de ser capaces de absorber, y permanecerán inmutables. Así, existe un enriquecimiento en la estadística de los cromóforos perpendiculares a la luz polarizada (revelación de agujereo orientacional). La irradiación polarizada creará material azo anisotrópico y, por lo tanto, ópticamente birrefringente y dicróico. Esta foto-orientación puede también ser utilizada para orientar otros materiales (especialmente en los sistemas de cristal líquido). Por ejemplo, ha sido utilizada para orientar selectivamente dominios de cristal líquido, y para crear materiales de ópticas no lineales (NLO, del inglés nonlinear optical). La isomerización azo también puede ser usada para foto-alternar la fase de cristal líquido de un material de colestérico a nemático o para cambiar el campo de una fase colestérica.
En 1995, fue relatado que exponiéndose una película fina de azo-polímero a un gradiente de intensidad (o polarización) de luz conduce a patrones espontáneos de superficie. En esencia, el material polímero se revelará reversiblemente de cara a minimizar la cantidad de material expuesto a la luz. Este fenómeno no es la ablación láser, dado que fácilmente ocurre dada la baja potencia y la transformación es reversible. El mecanismo de esta holografía de superficie parece estar asociado a un nuevo efecto fotomecánico, envolviendo la isomerización del azobenzeno.[12]
La expansión y contracción en mayores escalas de materiales azobenzénicos también fue observada. En un informe, una película fina fue hecha para doblarse y afrouxar-exponiéndose lo a la luz polarizada. La dirección del movimiento en el macroscópico podría ser controlado por la dirección de la polarización. La flexión ocurre porque la superficie libre del material se contrae más que el interior de la película más fina (debido a la absorción de luz láser que pasa a través de la película).[12]
Otros aspectos
Las moléculas de azobenzeno pueden incorporarse en matrices de polímeros como estabilizadores. Es también interesante notarse que la estructura, rígida como una barra de moléculas azo, les permite comportarse como mesogen de cristal líquido en muchos materiales.[13]
La modificación de la geometría en mayor escala asociada con la fotoisomerización del azobenzeno. También ha sido utilizada para controlar la actividad de proteínas con la luz. Al azobenzeno ha sido atribuida la aglutinantes (drogas) para fotomodular su afinidad a las proteínas. El azobenzeno ha sido empleado como un tirante fotointercambiable entre un aglutinante y la proteína: una extremidad del azobenzeno es sustituida por un grupo reactivo que se conecta a la proteína blanca. La otra extremidad presenta un aglutinante para la proteína. Dependiendo del local donde el azobenzeno esté acoplado, mientras el isómero trans o cis presente el aglutinamiento para el local de conexión, el otro isómero impide que el fármaco se aproxime del local. Una vez más, el fotointercambio entre isómeros transforma la proteína conectándose y desconectándose. Cuando aplicado a canales iónicos en el sistema nervioso, este abordaje proporciona control óptico de la actividad eléctrica en las neuronas.[14]
Referencias
- Número CAS
- Unión Internacional de Química Pura y Aplicada (2009). «azo compounds». Compendium of Chemical Terminology. Versión en línea (en inglés).
- Mitscherlich, E. (1834), "Ueber das Stickstoffbenzid". Ann. Pharm., 12: 311–314. doi 10.1002/jlac.18340120282
- "Control over molecular motion using the cis–trans photoisomerization of the azo group" Estíbaliz Merino and María Ribagorda Beilstein J. Org. Chem. 2012, 8, 1071–1090. doi 10.3762/bjoc.8.119
- Noble, Alfred (1856). «III. Zur Geschichte des Azobenzols und des Benzidins». Annalen der Chemie und Pharmacie 98 (2): 253-256. doi:10.1002/jlac.18560980211.
- Bigelow, H. E. (1955). "Azobenzene". Org. Synth. 22: 28; Coll. Vol. 3: 103.
- «Azobenzene». www.chemeurope.com (en inglés). Consultado el 17 de marzo de 2017.
- Fernández, Germán. «Isómeros geométricos o cis - trans». www.quimicaorganica.org. Consultado el 17 de marzo de 2017.
- Shahinpoor, Mohsen; Schneider, Hans-Jörg (1 de enero de 2008). Intelligent Materials (en inglés). Royal Society of Chemistry. ISBN 9780854043354. Consultado el 17 de marzo de 2017.
- Wei-Guang Diau, Eric (1 de febrero de 2004). «A New Trans-to-Cis Photoisomerization Mechanism of Azobenzene on the S1(n,π*) Surface». The Journal of Physical Chemistry A 108 (6): 950-956. ISSN 1089-5639. doi:10.1021/jp031149a. Consultado el 17 de marzo de 2017.
- Yu, Yanlei; Nakano, Makoto; Ikeda, Tomiki (11 de septiembre de 2003). «Photomechanics: Directed bending of a polymer film by light». Nature (en inglés) 425 (6954): 145-145. ISSN 0028-0836. doi:10.1038/425145a. Consultado el 17 de marzo de 2017.
- Yager, Kevin G.; Barrett, Christopher J. (1 de diciembre de 2006). «Photomechanical Surface Patterning in Azo-Polymer Materials». Macromolecules 39 (26): 9320-9326. ISSN 0024-9297. doi:10.1021/ma061733s. Consultado el 17 de marzo de 2017.
- Banghart, Matthew R.; Volgraf, Matthew; Trauner, Dirk (1 de diciembre de 2006). «Engineering Light-Gated Ion Channels». Biochemistry 45 (51): 15129-15141. ISSN 0006-2960. doi:10.1021/bi0618058. Consultado el 17 de marzo de 2017.
- Gorostiza, Pau; Isacoff, Ehud Y. (17 de octubre de 2008). «Optical Switches for Remote and Noninvasive Control of Cell Signaling». Science (en inglés) 322 (5900): 395-399. ISSN 0036-8075. PMID 18927384. doi:10.1126/science.1166022. Consultado el 17 de marzo de 2017.
Lectura adicional
- H. Rau, in Photochemistry and Photophysics; Vol. 2, editado por J. Rebek (CRC Press, Boca Raton, FL, 1990), p. 119-141.
- A. Natansohn y P. Rochon, Chem. Rev. 102, 4139-4176 (2002).
- Y. Yu, M. Nakano y T. Ikeda, Nature (Londres, U. K.) 425, 145 (2003).