Borohidruro de sodio
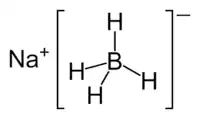
El borohidruro de sodio, con fórmula química NaBH4, es un agente reductor de carácter selectivo usado en la síntesis de fármacos y otros compuestos orgánicos. Es un sólido blanco, que se suele encontrar en forma granulada (polvo). Es soluble en alcoholes y agua, aunque reacciona con ellos con relativa lentitud (acentuada si se añade una base fuerte) formando hidrógeno (riesgo de explosión).[4]
| Borohidruro de sodio | |
|---|---|
 | |
| Nombre IUPAC | Tetrahidruroborato de sodio |
| Otros nombres | Borohidruro de sodio |
| Fórmula química | NaBH4 |
| Masa molecular | 37,83 g/mol |
| Estado físico/Color | Sólido/Blanco |
| Número CAS | 16940-66-2 |
| Propiedades | |
| Densidad | 1,07 g/cm³ a 20 °C |
| Punto de fusión | ~400 °C (~673 K) (Descomposición lenta) |
| Punto de ebullición | ~500 °C (~773K) (Descompone) |
| Solubilidad en agua | 550 g/l a 25 °C |
| Información de Seguridad | |
  | |
| Frases R: R15, R24/25, R35
Frases S: S14,S26,S36/37/39, S43,S45 | |
| NFPA 704 |
2
3
2
|
| Exenciones y Referencias[1][2][3] | |
El compuesto fue descubierto en los años 1940 por un equipo liderado por H.I. Schlessinger, en el que se desarrollaban borohidruros de metales para aplicaciones bélicas.[5]
Síntesis
El borohidruro de sodio se prepara mediante la reacción de hidruro de sodio con borato de trimetilo a 250 °C en tetrahidrofurano y bajo presión.
- B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Puede ser generado también por la acción de NaH sobre vidrio borosilicato pulverizado.[6]
El NaBH4 puede ser recristalizado disolviéndolo en diglime a 50 °C y a continuación enfriando la solución.[7]
Reactividad
Aplicaciones en síntesis orgánica
El borohidruro de sodio reduce aldehídos y cetonas a alcoholes, pero, a diferencia del más enérgico agente reductor hidruro de litio y aluminio, en general no reducirá ésteres, amidas o sales de ácidos carboxílicos.[4]
En general la reactividad de los hidruros de boro puede ser modificada por cambios, en apariencia sutiles, de su estructura. Por ejemplo, el cianoborohidruro de sodio (NaBH3CN) se usa principalmente para llevar a cabo de forma directa aminaciones reductivas, donde un grupo carbonilo es convertido en una amina en una única etapa sintética, aprovechando que el NaBH3CN reacciona muy lentamente con el carbonilo, mientras sí reduce la imina conforme se forma a amina en el mismo medio de reacción. El reactivo conocido comercialmente como L-Selectride (tris(sec-butil)borohidruro de litio, [Li(secBu)3BH]) es un reactivo, dado su volumen, mucho más selectivo, en concreto el de máxima estereoselectividad, que el NaBH4, por motivos estéricos.[8]
Otras reacciones
El NaBH4 es un reactivo, a nivel laboratorio, utilizado en la síntesis de borano. Por ejemplo, de entre los diversos métodos existentes, su oxidación con yodo (I2) en THF conduce al aducto BH3-THF, cuya principal aplicación como reductor es la reducción selectiva del grupo carboxilo (-COOH) a alcohol.
El BH4- es un excelente ligando para iones metálicos, en especial con metales muy electropositivos, por ejemplo Zr(BH4)4. Tales complejos de borohidruro son a menudo preparados por la acción de NaBH4 (o LiBH4) sobre el correspondiente haluro metálico.
Pilas de combustible
El borohidruro de sodio también es usado en pilas de combustible experimentales como un medio de almacenar hidrógeno. Como pila, es menos inflamable y menos volátil que la gasolina, pero más corrosivo. Es relativamente respetuoso con el medio ambiente ya que de producirse un vertido se degradará rápidamente a sales inertes. El hidrógeno es generado en la pila de combustible a través de la descomposición catalítica de una solución acuosa del borohidruro:
- NaBH
4 + 2H
2O → NaBO
2 + 4H
2
Seguridad
Descompone en borano e hidrógeno rápidamente con ácidos. Inflamable.
Referencias
- Fichas de datos de seguridad (FDS)
- Hazardous Substances Data Bank (HSDB)
- Material Safety Data Sheets (MSDS)
- Banfi, L.; Narisano, E.; Riva, R. “Sodium Borohydride” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York.
- Schlesinger, H. I.; Brown, H. C.; Abraham, B.; Bond, A. C.; Davidson, N.; Finholt, A. E.; Gilbreath, J. R.; Hoekstra, H.; Horvitz, L.; Hyde, E. K.; Katz, J. J.; Knight, J.; Lad, R. A.; Mayfield, D. L.; Rapp, L.; Ritter, D. M.; Schwartz, A. M.; Sheft, I.; Tuck, L. D.; Walker, A. O. “New developments in the chemistry of diborane and the borohydrides. General summary” Journal of the American Chemical Society 1953, volume 75, pages 186-90,doi 10.1021/ja01097a049.
- Schubert, F.; Lang, K.; Burger, A. “Alkali metal borohydrides” (Bayer), 1960. German patent DE 1088930 19600915 (ChemAbs: 55:120851). Supplement to. to Ger. 1,067,005 (CA 55, 11778i). Del resumen: “Alkali metal borosilicates are treated with alkali metal hydrides in approx. 1:1 ratio at >100° with or without H pressure”.
- Brown, H. C. “Organic Syntheses via Boranes” John Wiley & Sons, Inc. New York: 1975. ISBN 0-471-11280-1. page 260-1.
- Seyden-Penne, J. "Reductions by the Alumino- and Borohydrides in Organic Synthesis"; VCH–Lavoisier: Paris, 1991.
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- A.G. Sharpe (1993). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7501-6.
- D.F. Shriver, P.W. Atkins, C.H. Langford (1998). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7006-5.
Enlaces externos
- http://chemdat.merck.de/documents/sds/emd/esp/es/8063/806373.pdf FDS
- https://www.spectrumchemical.com/MSDS/S3730.pdf MSDS
