Célula caliciforme
Las células caliciformes, son células epiteliales especializadas o "glándulas unicelulares" secretoras de mucus, presentes en los revestimientos epiteliales de las mucosas de las vías respiratorias y el aparato digestivo.[1]
Las células caliciformes también secretan proteínas antimicrobianas, quimiocinas y citocinas que demuestran funciones en la inmunidad innata, más allá del mantenimiento de una barrera.[2]
Clínicamente las células caliciformes están asociadas con enfermedades respiratorias y con enfermedades inflamatorias del intestino.[3]

Estructura
Las células caliciformes son células exócrinas, secretoras de mucus altamente polarizadas, presentes dentro de las mucosas.[4] Las estructuras y funciones de los diferentes sectores polarizados se resumen en el término dominios. Existen por tanto: dominios morfológicos, bioquímicos y funcionales definidos.[5] [6]
- Microarquitectura
Muestran forma de cáliz, cilindro o huso con el extremo distal o el sector central ensanchado.
El dominio celular apical es el excretor, está ocupado completamente por glóbulos de mucina y se abre al exterior. En el dominio central se disponen las numerosas mitocondrias y un aparato de Golgi grande.
El dominio basal está en contacto con la membrana basal y es donde se localiza el núcleo celular.
- Ultraestructura

La microscopía electrónica ha permitido el estudio exhaustivo de la citoarquitectura de la célula caliciforme. Se han determinado dominios celulares bien caracterizados.
- El dominio celular apical,
- muestra una membrana celular fenestrada por los glóbulos de mucina que secreta.
- Los microtúbulos y microfilamentos son una población dinámica, que están alineados a lo largo del eje largo de estas células, se observan asociados estrechamente con los gránulos de mucina y unas mitocondrias filamentosas.[7]
- Los microtúbulos son necesarios para mantener el transporte de gránulos de mucina en las células caliciformes.[8] [4]
- En células caliciformes normales, la proteína contráctil actina-F está restringida a la superficie apical de la célula.[9]
- Los filamentos de actina cumplen una función de barrera para la secreción, al dificultar el acceso de los gránulos de mucina a la membrana plasmática.
- El moco producido por una célula caliciforme, es secretado a la luz mediante exocitosis de los gránulos de mucina. Los orificios de las células caliciformes y la membrana plasmática fenestrada se extienden profundamente en la copa de esta célula.[10]
- El dominio celular medio,
- es el dominio secretor y está formado por el aparato de Golgi con cisternas extensas, por vesículas nacientes a partir del trans-Golgi y por parte del retículo endoplásmico.
- Una capa de citoplasma llamado "theca" rica en filamentos, separa la masa de gránulos de mucina de la membrana celular lateral y también los separa de la región supranuclear ocupada por el Golgi.[11]
- Está formada por dos capas de filamentos intermedios (con diámetro de 10 nm): una interna con forma de red, cercana a la pared de las extensas cisternas del Golgi y una capa externa con forma de manojos de filamentos circunferenciales, dispuestos como aros.
- El dominio celular basal,
- está ocupado por: el núcleo, retículo endoplásmico y mitocondrias, todos en cercanía estrecha con la membrana basal.
Función

La función primaria de las células caliciformes es sintetizar y secretar mucus.[3]
El moco producido por una célula caliciforme es secretado a la luz en cuestión mediante exocitosis y diluido con agua con el fin de revestir el epitelio expuesto a acciones nocivas presentes en los tubos digestivos o respiratorios.[12]
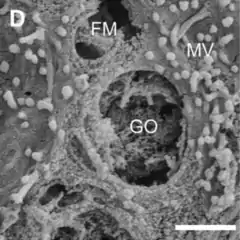
Las células caliciformes son las secretoras primarias del epitelio de las grandes vías aéreas, secretan las glicoproteínas mucina, las cuales son el principal componente macromolecular del mucus.[3] El componente principal del moco son las mucinas, que son glicoproteínas grandes poliméricas, unidas a numerosas cadenas laterales de oligosacáridos higroscópicos e hidrofílicos que contribuyen a la formación de una estructura tipo gel.[13]
Tiene una función importante de mantener húmeda y evitar la desecación del epitelio, en particular en las vías aéreas. Posee una vía secretora de base, que depende del citoesqueleto para el movimiento de los gránulos, y una vía secretora acelerada, que es independiente del citoesqueleto pero requiere una señal extracelular para ocurrir.[4]
Recambio de células caliciformes
Las células caliciformes son renovadas continuamente cada 3-7 días, a partir de las células madre del epitelio.[3]
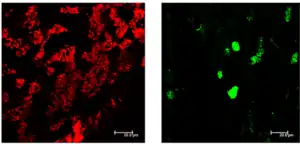

Las células caliciformes intestinales migran y maduran desde la base de la cripta hasta la superficie del epitelio, en ese proceso presentan cambios de forma y de volumen.
Después de la diferenciación, las células caliciformes alcanzan una forma piramidal amplia, en el tercio basal de la cripta. Las células se alargan y disminuyen de volumen a medida que se mueven hacia la superficie; la disminución es desproporcionadamente grande en el retículo endoplasmático rugoso (RER). Esta pérdida de gránulos y orgánulos, se produce como consecuencia de la síntesis y secreción continua de gránulos de mucina.[14]
Cultivo y organoides
Se han optimizado las condiciones de cultivo in vitro tridimensional (3D) de los organoides
Galería
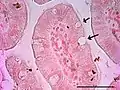 Células caliciformes productoras del moco en el íleon de ratón.
Células caliciformes productoras del moco en el íleon de ratón.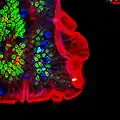 Sección del intestino de un ratón con las células caliciformes teñidas de azul.
Sección del intestino de un ratón con las células caliciformes teñidas de azul.
Véase también
Referencias
- Megías M., Molist P., Pombal M.A. (2019 ). «Glándulas Unicelulares Intraepiteliales». Atlas de histología vegetal y animal. Tejidos animales. Consultado el 6 de mayo de 2020.
- Knoop K.A., Newberry R.D. (2018). «Goblet cells: multifaceted players in immunity at mucosal surfaces». Mucosal Immunology (Review) 11: 1551-1557. Consultado el 8 de mayo de 2020.
- Dao D.PD, Le P.H. (2020). Histology, Goblet Cells. StatPearls Publishing LLC. Consultado el 8 de mayo de 2020.
- Specian R.D., Oliver M.G. (1991). «Functional Biology of Intestinal Goblet Cells». Am J Physiol (Revisión). 260 (2 Pt 1): C183-193. doi:10.1152/ajpcell.1991.260.2.C183. Consultado el 8 de mayo de 2020..
- Welsch U., Sobotta J. (2008). «3:Tejido epitelial». Histología. Médica Panamericana. p. 86. Consultado el 11 de mayo de 2020.
- «Polaridad y especializaciones de la superficie celular». Universidad Autónoma de Zacatecas. Archivado desde el original el 14 de abril de 2021. Consultado el 11 de mayo de 2020.
- Adler K.B., Hardwick D.H., Craighead J.E. (1982). «Porcine Tracheal Goblet Cell Ultrastructure: A Three-Dimensional Reconstrucción». Journal Experimental Lung Research 3 (1). Consultado el 10 de mayo de 2020.
- Picone R., Ren X., Ivanovitch K.D., Clarke J.D.W., McKendry R.A., Baum B. (2010). «A Polarised Population of Dynamic Microtubules Mediates Homeostatic Length Control in Animal Cells.». PLoS Biol 8 (11): e1000542. doi:10.1371/journal.pbio.1000572. Consultado el 10 de mayo de 2020.
- Oliver M.G., Specian R.D. (1990). «Cytoskeleton of intestinal goblet cells: role of actin filaments in baseline secretion». Am J Physiol. 259(6 Pt 1): G991-997. Consultado el 8 de mayo de 2020.
- Ambrosini YM, Park Y, Jergens AE, Shin W, Min S, Atherly T, et al. (2020). «Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions». PLoS ONE 15 (4): e0231423.
- Deyrup-Olsen I., Luchtel D.L. (1998). «2:Secretion of mucous granules and other membrane bound structures: A look beyond exocytosis». En Jeon K.W., ed. International Review of Cytology 183. Academic Press. pp. 103-104. Consultado el 10 de mayo de 2020.
- Chihiro Sasakawa (29 de octubre de 2009). Molecular Mechanisms of Bacterial Infection Via the Gut. Springer. p. 11. ISBN 978-3-642-01845-9. Consultado el 13 de mayo de 2012.
- Kim Y. S., Ho S.B. (2010). «Intestinal Goblet Cells and Mucins in Health and Disease: Recent Insights and Progress». Current Gastroenterology Reports 12: 319-330. Consultado el 8 de mayo de 2020.
- Radwan K.A., Oliver M.G., Specian R.D. (1990). «Cytoarchitectural Reorganization of Rabbit Colonic Goblet Cells During Baseline Secretion». Am J Anat 189 (4): 365-376. PMID 2285043. doi:10.1002/aja.1001890408.
