Cafeato O-metiltransferasa
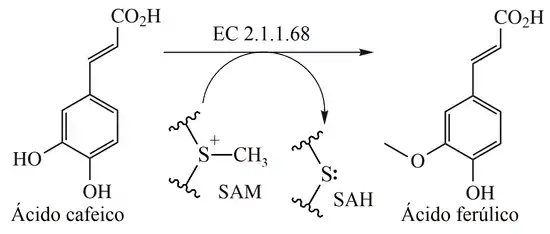
En enzimología, la cafeato O-metiltransferasa (EC 2.1.1.68 2.1.1.68) es una enzima que cataliza la reacción química: S-adenosil-L-metionina + ácido cafeico S-adenosil-L-homocisteína + ácido ferúlico.
| Cafeato O-metiltransferasa | ||||
|---|---|---|---|---|
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 2.1.1.68 | |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Por lo tanto, los dos sustratos de esta enzima son S-adenosilmetionina (SAM) y 3,4-dihidroxi-trans-cinamato (ácido cafeico), mientras que sus dos productos son S-adenosilhomocisteína (SAH) y 3-metoxi-4-hidroxi-trans-cinamato (ácido ferúlico). El 3,4-dihidroxibenzaldehído y el catecol pueden actuar como aceptores, pero más lentamente. Se ha demostrado que tanto la reacción de metilación de cafeato a ferulato y 5-hidroxferulato a sinapato en la biosíntesis de ligninas de guaiacilo y siringilo en angiospermas, son catalizadas por esta misma enzima (el estudio se realizó en bambú): el cafeato y el 5-hidroxiferulado compiten entre sí en la formación del complejo enzima-sustrato, el último sustrato muestra una mayor afinidad por la enzima. Por lo tanto, el control de retroalimentación puede operar en la etapa de metilación, cafeato a ferulato, en la biosíntesis de la lignina de angiospermas. Por ende, esta enzima participa en la biosíntesis de fenilpropanoides, ruta del ácido shikímico.
Esta enzima pertenece a la familia de las transferasas, específicamente aquellas que transfieren unidades de carbono llamadas metiltransferasas. El nombre sistemático de esta clase de enzimas es S-adenosil-L-metionina: 3,4-dihidroxi-trans-cinamato 3-O-metiltransferasa.
Fue reportada por primera vez por Poult y colaboradores, quienes la caracterizaron y purificaron a partir de la remolacha (Beta vulgaris L). Se ha estudiado y reportado en otros organismos vegetales como Vanilla planifolia, Arabidopsis thaliana, Brachypodium distachyon, Zea mays, entre otros.
Referencias
- Hahlbrock K; Schaller-Hekeler, B; Knobloch, KH; Wellman, E; Grisebach, H; Hahlbrock, K (1974). «Coordinated changes in enzyme activities of phenylpropanoid metabolism during the growth of soybean cell suspension cultures». Biochim. Biophys. Acta 362 (3): 417-24. PMID 4472044. doi:10.1016/0304-4165(74)90137-8.
- «Purification and properties of S-adenosyl-L-methionine: caffeic acid O-methyltransferase from leaves of spinach beet (Beta vulgaris L)». Biochim. Biophys. Acta 403 (2): 301-14. 1975. PMID 241400. doi:10.1016/0005-2744(75)90060-1.
- «Evidence for the formation of methoxyl groups of ferulic and sinapic acid in Bambusa by the same O-methyltransferase». Phytochemistry 12 (12): 2873-2875. 1973. doi:10.1016/0031-9422(73)80498-4.