Carbino
En química, un carbino es una especie de carbono monovalente radical que contiene un átomo de carbono univalente eléctricamente neutro con tres electrones no enlazados.[1] Es más fuerte y más rígido que cualquier otro material conocido. De hecho, el carbino es aproximadamente 2 veces más fuerte que el grafeno y nanotubos de carbono, que hasta ahora eran los materiales más fuertes. El carbino tiene una larga lista de propiedades inusuales y muy deseable que lo convierten en un material interesante para una amplia gama de aplicaciones.[2]
Formado por carbono e hidrógeno, esta molécula, que se detectó por primera vez en los años 30 del siglo XX.[3] El carbino tiene unas propiedades mecánicas que no se pueden comparar con las de ningún otro material conocido, ya que supera incluso las de resistencia mecánica y flexibilidad del grafeno y del diamante. Además, sus características electrónicas sugieren nuevas aplicaciones nanoelectrónicas.[4]
Fase gaseosa/intermediario reactivo
Un carbino puede obtenerse como un intermediario reactivo de corta duración. Por ejemplo, el fluorometilidino (CF) puede ser detectado en fase gaseosa mediante espectroscopia como un intermediario en la fotólisis flash del CHFBr2.[5] El átomo de carbono está generalmente en un estado electrónico doblete: los electrones de valencia se arreglan como un radical (electrón desapareado) y un par de electrones, dejando un orbital atómico vacante, en vez de comportarse como un tri-radical. El átomo de carbono tiene una hibridación compleja, así que el análisis de la Regla de Hund simple de un átomo simple que contiene tres orbitales p (o cuatro orbitales híbridos sp3) no es correcto
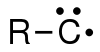 doblete (1 radical, 1 par, 1 orbital vacante).
doblete (1 radical, 1 par, 1 orbital vacante).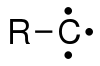 cuartete (3 radicales).
cuartete (3 radicales).
Ligando organometálico
La química de los complejos carbino es un área de gran interés dentro de la química organometálica. Los carbinos son incorporados en complejos con metales de transición[6][7] como un ligando trivalente. Por ejemplo, en [WBr(CO)2(2,2'-bipiridina)C-Aril] y [WBr(CO)2(PPh3)2C-NR2]. Un ejemplo de cómo hacer tales compuestos sería hacer reaccionar [W(CO)6] con diisopropilamida de litio para formar [(iPr2N)(OLi)C=W(CO)5]. Esto es hecho reaccionar después con ya sea bromuro de oxalilo o dibromuro de trifenilfosfina seguido de trifenilfosfina. Otro método es tratar un carbeno metoxi metálico con un ácido de Lewis.[8]
Materialización del Carbino
Un grupo de investigación ha presentado ahora una nueva y simple vía para estabilizar cadenas de carbono de más de 6.400 átomos de carbono, más fuerte, más resistente y más flexible que cualquier otro material de carbono, considerado imposible de hacer. Para ello, han utilizado el espacio confinado dentro de un nanotubo de carbono de pared doble, como nanoreactor, para hacer crecer cadenas de carbono ultralargas, que, confiere una gran estabilidad a las mismas. Esta estabilidad es de suma importancia para futuras aplicaciones.[4]
En 2003
Se logra sintetizar una cadena de carbino de 100 átomos, en nanotubos con más de 100 paredes. Sin embargo, la cantidad de paredes impedía usar las propiedades intrínsecas del carbino.[9]
En 2010
Científicos logran sintetizar 44 átomos de carbono, en una cadena univalente, mediante una técnica de estabilización en suspensión.[9]
En 2016
Utilizan únicamente dos nanotubos concéntricos (uno dentro del otro) donde el diámetro del interior es perfecto para que pueda formar una cadena lineal de carbonos estable (el carbino). Con esto se logró producir este material por primera vez, además se demostró que es tan eficiente que una sola cadena llega a tener más de 6,000 átomos. Esto permite una gama de posibilidades para poder estudiar las propiedades intrínsecas del carbino.[9]
Referencias
- IUPAC, Compendium of Chemical Terminology, 2a ed. (the "Gold Book") (1997). Versión corregida online: (2006–) "carbinos"
- “Carbyne: A new form of carbon that´s stronger than grapheme” en Technology.org. 2013/08/16. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).
- «Cómo la formación de una estrella puede ayudar a crear nuevos fármacos».
- «Sintetizadas las primeras cadenas ultralargas de carbino».
- Ruzsicska, B. P.; Jodhan, A.; Choi; H. K. J., Strausz, O. P.; Bell, T. N. (1983). «Chemistry of carbynes: reaction of CF, CCl, and CBr with alkenes». J. Am. Chem. Soc. 105: 2489-2490. doi:10.1021/ja00346a072.
- Furno, F.; Fox, T.; Berke, H. Copia archivada. EURO-HYDRIDES 2000. Archivado desde el original el 30 de septiembre de 2007. Consultado el 5 de agosto de 2006.
|title=y|título=redundantes (ayuda) - Detalles de su reactividad y la de los carbenos relacionados se muestran en este enlace.
- Jaeger, M.; Stumpf, R.; Troll, C.; Fischer, H. (2000). «Novel hepta-coordinated molybdenum(II) and tungsten(II) carbene complexes by oxidative decarbonylation of Mo(0) and W(0) carbene complexes». Chem. Commun.: 931-932. doi:10.1039/B002228O.
- «MATERIALIZACIÓN DEL CARBINO».
Enlaces externos
- Esta obra contiene una traducción derivada de «Carbyne» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.