Cariogamia
La cariogamia es el paso final en el proceso de fusión de dos células eucariontes haploides, y se refiere específicamente a la fusión de los dos núcleos celulares. Antes de la cariogamia, cada célula haploide tiene una copia completa del genoma del organismo. Para que la cariogamia ocurra, la membrana celular y el citoplasma de cada célula deben fusionarse en un proceso conocido como plasmogamia. Una vez dentro de la membrana celular fusionada, los núcleos se denominan pronúcleos. Una vez que las membranas, citoplasmas y pronúcleos se fusionan el resultado es una sola célula diploide que contiene dos copias del genoma. Esta célula diploide llamada cigoto (o zigospora en el caso de hongos) puede entrar a la meiosis (proceso de duplicación, recombinación y división de los cromosomas para producir cuatro nuevas células haploides), o dividirse por mitosis. En mamíferos, la fertilización comprende un proceso comparable para combinar a los espermatozoides y óvulos (gametos haploides) para crear un óvulo fertilizado diploide.

El término cariogamia proviene del Griego κάρυον (káryon) que significa "nuez" y γάμος (gámos), que significa "matrimonio".[1]
Importancia en células haploides
.
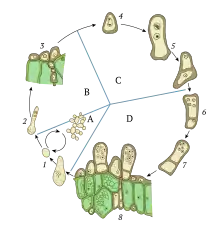
Los organismos haploides tales como los hongos, las levaduras y las algas pueden tener ciclos celulares complejos, en los cuales la opción entre reproducción sexual y reproducción asexual es variable, y a menudo influenciada por el medio ambiente. Algunos organismos, además de su estado usual como haploides, pueden existir como diploides por un periodo corto de tiempo, permitiendo así la recombinación genética. La cariogamia puede ocurrir en ambos modos de reproducción: durante el ciclo sexual o durante el ciclo somático (no reproductivo) de la célula.[2]
Por tanto, la cariogamia es el paso clave para unir dos conjuntos de material genético diferente que pueden recombinarse durante la meiosis. En organismos haploides que carecen ciclos sexuales, la cariogamia también puede ser una importante fuente de variación genética durante el proceso de la formación de células somáticas diploides. La formación de células somáticas diploides evita el proceso de formación de gametos durante el ciclo de reproducción sexual y en su lugar crea variaciones de las células somáticas de un organismo ya desarrollado, un hongo por ejemplo.[2]
Rol de la cariogamia en la reproducción sexual

El rol de la cariogamia en la reproducción sexual puede ser demostrado de manera simple por organismos haploides unicelulares como las algas del género Clamidomonas o la levadura Saccharomyces cerevisiae. Tales organismos existen normalmente en estado haploide, contienen solo un conjunto de cromosomas por célula. Sin embargo, el mecanismo es en gran medida el mismo entre todos los eucariontes haploides.[3]
Cuando las células son sujetas a estrés ambiental, tal como inanición de nitrógeno en el caso de Clamidomonas, éstas son inducidas a formar gametos.[4] La formación de gametos en organismos unicelulares haploides tales como las levaduras es llamada esporulación, que resulta en múltiples cambios celulares que incrementan la resistencia al estrés. La formación de gametos en hongos multicelulares ocurre usualmente por meiosis en el gametangio, un órgano especializado para dicho proceso.[5] Cuando tipos sexuales se encuentran, ambos son inducidos a salir del ciclo vegetativo y entrar al ciclo reproductivo. En levaduras hay dos tipos de apareamiento, a y α.[6] En los hongos en general puede haber dos, cuatro, o hasta 10,000 tipos sexuales, dependiendo de la especie.[7][8] El reconocimiento de una pareja sexual en eucariontes simples se logra a través de señalización por feromonas, que induce la formación de un "shmoo" (un nódulo en la célula) y comienza el proceso de organización y migración de microtúbulos. Las feromonas usadas en el reconocimiento del tipo sexual son péptidos regularmente, pero algunas veces el ácido trispórico y otras moléculas pueden ser reconocidas como feromonas por receptores en la célula opuesta. Notablemente, la señalización por feromonas está ausente en hongos superiores tales como las setas.[3]
Las membranas y los citoplasmas de estas células haploides se fusionan en un proceso denominado plasmogamia. Este proceso resulta en una sola célula con dos núcleos, denominados pronúcleos. Los pronúcleos se fusionan en un proceso regulado conocido como cariogamia. La cariogamia produce una célula diploide llamada cigoto (o zigospora en hongos),[4] que puede comenzar la meiosis, un proceso de duplicación de cromosomas, recombinación y división celular para crear cuatro nuevos gametos haploides. La ventaja de la reproducción sexual es la misma en cualquier organismo: mayor variabilidad genética, facilitando la oportunidad de adaptación por medio de la selección natural. Por ello, la cariogamia es el paso clave para juntar una variedad de material genético y asegurar la recombinación por meiosis.[3]
Mecanismo celular
Migración pronuclear

El objetivo de la cariogamia es la fusión de dos núcleos haploides. El primer paso del proceso es el desplazamiento de los dos pronúcleos uno hacia el otro, lo que ocurre directamente después de la plasmogamia. Cada pronúcleo tiene un solo cuerpo polar del huso que está dentro de la membrana nuclear y sirve como un punto de anclaje para los microtúbulos. Los microtúbulos, un componente importante del citoesqueleto similares a una fibra, emergen del cuerpo polar del huso. El punto de anclaje al cuerpo polar marca el polo negativo, el polo positivo se extiende al citoplasma. El polo positivo tiene un rol normal en la mitosis, pero durante la reunión nuclear los polos positivos son redireccionados. El polo positivo se fija al pronúcleo opuesto, resultando en la tracción de los dos pronucleos el uno hacia el otro.[9]
El movimiento de los microtúbulos es mediado por una familia de proteínas motoras conocidas como cinesinas, tal como la Kar3 en levaduras. Las proteínas accesorias tales como Spc72 en levaduras actúan como pegamento, conectando las proteínas motoras, el cuerpo polar y la estructura de microtúbulos conocida como medio puente. Otras proteínas tales como Kar9 y Bim1 en levaduras, se fijan al polo positivo de los microtúbulos. Son activadas por señales de feromonas para fijarse a la punta del shmoo. Un shmoo es una proyección de la membrana celular que actúa como punto inicial de la fusión celular en la plasmogamia. Después de la plasmogamia, los polos positivos de los microtúbulos siguen extendiéndose hacia el pronúcleo opuesto. Se piensa que el polo positivo que crece se fija directamente a la proteína motora del pronúcleo opuesto, iniciando una reorganización de las proteínas en el medio puente.[10]
Se han propuesto dos modelos de reunión nuclear: el de puente deslizante y el modelo de polo positivo. En el primero, los microtúbulos antiparalelos recorren toda la distancia entre los dos pronúcleos, formando enlaces cruzados, y fijándose al núcleo opuesto en el polo positivo. Este es el modelo favorecido. El modelo alternativo propone que los polos positivos se tocan uno al otro a mitad de camino entre los dos pronúcleos y sólo se sobreponen ligeramente. En ambos modelos, se cree que el acortamiento de microtúbulos ocurre en el polo positivo y requiere Kar3p (en levaduras), un miembro de la familia de cinesinas.[9]
Se ha demostrado que la organización de los microtúbulos en el citoesqueleto es esencial para lograr una reunión nuclear exitosa durante la cariogamia. Una organización deficiente de los microtúbulos causaría una falla catastrófica de la cariogamia, pero no interrumpiría la meiosis completamiente ni la producción de esporas en levaduras. La falla ocurriría porque el proceso de reunión nuclear no puede ocurrir sin microtúbulos funcionales. Por consiguiente, los pronúcleos no se acercarían lo suficiente para fusionarse, y el material genético permanecería disgregado.[11]
Fusión pronuclear (cariogamia)
La fusión de la membrana nuclear ocurre en 3 pasos: fusión de la membrana exterior, fusión de la membrana interior y fusión de los cuerpos polares del huso. En levaduras, varios miembros de la familia proteica Kar, así como la protamina, son requeridas para la fusión de la membrana exterior. La protamina Prm3 está localizada en la superficie exterior de cada membrana nuclear, y se requiere para la fusión de la membrana exterior. El mecanismo preciso es aún desconocido. Kar5, una cinesina, es necesaria para expandir la distancia entre las membranas interiores y exteriores en un fenómeno conocido como puente de expansión. Se piensa que Kar8 y Kar2 son necesarias para la fusión de las membranas interiores.[12] Como se describe arriba, la reorganización de las proteínas accesorias y motoras durante la migración pronuclear también sirve para orientar los cuerpos polares del huso en la dirección correcta para lograr una reunión nuclear eficiente. La reunión nuclear puede ocurrir sin esta orientación previa de los cuerpos polares, pero es más lenta. Al final, los dos pronúcleos combinan los contenidos de sus nucleoplasmas y forma una sola envoltura a su alrededor como resultado.[10]
Papel de la cariogamia en células somáticas diploides
Aunque los hongos son regularmente haploides, existen dos mecanismos con los que pueden surgir células diploides. El primero es una falla en la separación mitótica durante la división celular, y no involucra al proceso de cariogamia. La célula resultante únicamente puede ser homocigótica ya que es producida a partir de una célula haploide. El segundo mecanismo, que involucra la cariogamia de células somáticas, puede producir diploides heterocigótica si los dos núcleos difieren en su información genética. La formación de células somáticas diploides es por lo general poco común, y se piensa que ocurre debido a una mutación en el gen represor de la cariogamia (KR).[2]
Sin embargo, existen algunos hongos con células mayoritariamente diplodes. Un ejemplo es Candida albicans, un hongo que habita en el tracto grastrointestinal de muchos animales de sangre caliente, incluyendo a los seres humanos. Aunque es normalmente inocuo, C. albicans puede volverse patógeno y es un inconveniente particular en pacientes bajo tratamiento inmunosupresor. A diferencia de muchos otros hongos, se pueden fusionar células diploides de diferentes tipos sexuales para crear células tetraploides que subsecuentemente regresen a un estado diploide, perdiendo cromosomas.[13]
Semejanzas y diferencias con la fertilización mamífera
Los mamíferos, incluyendo a los seres humanos, también combinan el material genético de dos fuentes (padre y madre) durante la fertilización. Este proceso es similar a la cariogamia. Análogamente a la cariogamia, los microtúbulos juegan una parte importante en la fertilización y son necesarios para la unión del ADN del espermatozoide y del óvulo (oocito).[14] Sustancias como la griseofulvina, que interfiere con los microtúbulos, previenen la fusión de los pronúcleos del espermatozoide y del óvulo. El gen KAR2, importante para el proceso de cariogamia, tiene un análogo en los mamíferos llamado Bib/GRP78.[15] En ambos casos, el material genético se combina para crear una célula diploide que tiene mayor diversidad genética que cualquiera de las fuentes originales.[16] En contraste con la fusión celular (plasmogamia), que toma lugar en eucariontes menores, en mamíferos el esperma se fusiona con la membrana exterior del oocito e inyecta el núcleo y centriolo. La mitocondria y otros componentes del esperma nunca entran al oocito. En lugar de fusionarse de la misma manera que en los eucariontes menores por cariogamia, el núcleo del esperma se vesícula y su ADN se descondensa. El centriolo del esperma actúa como centro organizador de microtúbulos y forma un huso que se extiende por el interior del óvulo hasta que se contacta con el núcleo. Los dos pronúcleos migran uno hacia el otro y después se fusionan para formar una célula diploide.[17]
Véase también
Referencias
- ["http://www.thefreedictionary.com/karyogamy" «karyogamy»]. The Free Dictionary.
- Cole, Garry T. (2 de diciembre de 2012). Biology Of Conidial Fungi. Elsevier. ISBN 9780323143547.
- Ni, Min; Marianna Feretzaki; Sheng Sun; Xuying Wang; Joseph Heitman (diciembre de 2011). «Sex in Fungi». Annual Review of Genetics 45: 405-430. doi:10.1146/annurev-genet-110410-132536.
- Raven, Peter H.; Ray Franklin Evert; Susan E. Eichhorn (enero de 2005). Biology of Plants. Macmillan. ISBN 9780716710073.
- Ünal, E.; A. Amon (1 de enero de 2011). «Gamete Formation Resets the Aging Clock in Yeast». Cold Spring Harbor Symposia on Quantitative Biology 76: 73-80. ISSN 0091-7451. doi:10.1101/sqb.2011.76.011379. Consultado el 23 de noviembre de 2013.
- Guthrie, Christine; Gerald R. Fink (2004). Guide to Yeast Genetics and Molecular and Cell Biology. Gulf Professional Publishing. ISBN 9780121827786.
- Volk, Tom. «Tom Volk's Fungus of the Month for February 2000». Tom Volk's Fungi. University of Wisconsin-La Crosse. Consultado el 14 de diciembre de 2013.
- Hodge, Kathie. «A fungus walks into a singles bar». Cornell Mushroom Blog. Cornell University. Consultado el 23 de noviembre de 2013.
- Molk, Jeffrey N.; E. D. Salmon; Kerry Bloom (2 de enero de 2006). «Nuclear Congression Is Driven by Cytoplasmic Microtubule Plus End Interactions in S. cerevisiae». The Journal of Cell Biology 172 (1): 27-39. ISSN 0021-9525. JSTOR 4134115. doi:10.1083/jcb.200510032.
- Gibeaux, Romain; Antonio Z. Politi; François Nédélec; Claude Antony; Michael Knop (1 de febrero de 2013). «Spindle pole body-anchored Kar3 drives the nucleus along microtubules from another nucleus in preparation for nuclear fusion during yeast karyogamy». Genes & Development 27 (3): 335-349. ISSN 0890-9369. doi:10.1101/gad.206318.112. Consultado el 29 de octubre de 2013.
- Yamashita, Akira; Yoshihiro Fujita; Masayuki Yamamoto (5 de junio de 2013). «Proper Microtubule Structure Is Vital for Timely Progression through Meiosis in Fission Yeast». PLoS ONE 8 (6): e65082. doi:10.1371/journal.pone.0065082. Consultado el 29 de octubre de 2013.
- Melloy, Patricia; Shu Shen; Erin White; Mark D. Rose (1 de septiembre de 2009). «Distinct Roles for Key Karyogamy Proteins during Yeast Nuclear Fusion». Molecular Biology of the Cell 20 (17): 3773-3782. ISSN 1059-1524. doi:10.1091/mbc.E09-02-0163. Consultado el 23 de noviembre de 2013.
- Noble, Suzanne M.; Johnson, Alexander D. (diciembre de 2007). «Genetics of Candida albicans, a Diploid Human Fungal Pathogen». Annual Review of Genetics 41 (1): 193-211. doi:10.1146/annurev.genet.41.042007.170146.
- Schatten, G; Simerly, C; Schatten, H (Jun 1985). «Microtubule configurations during fertilization, mitosis, and early development in the mouse and the requirement for egg microtubule-mediated motility during mammalian fertilization.». Proceedings of the National Academy of Sciences of the United States of America 82 (12): 4152-6. PMID 3889922. doi:10.1073/pnas.82.12.4152.
- Rose, Mark D.; Misra, Leanne M.; Vogel, Joseph P. (1 de junio de 1989). «KAR2, a karyogamy gene, is the yeast homolog of the mammalian BiP/GRP78 gene». Cell 57 (7): 1211-1221. doi:10.1016/0092-8674(89)90058-5.
- Wassarman, PM; Jovine, L; Litscher, ES (Feb 2001). «A profile of fertilization in mammals.». Nature Cell Biology 3 (2): E59-64. PMID 11175768. doi:10.1038/35055178.
- Wassarman, Paul M.; Jovine, Luca; Litscher, Eveline S. (1 de febrero de 2001). «A profile of fertilization in mammals». Nature Cell Biology 3 (2): E59-E64. PMID 11175768. doi:10.1038/35055178.