Cavicularina
La cavicularina es un metabolito fenolico natural secundario aislado de la hepática Cavicularia densa. Este macrociclo es inusual porque era el primer compuesto aislado de la naturaleza que presenta actividad óptica debido únicamente a la presencia de quiralidad planar y quiralidad axial. La rotación específica de la (+)-cavicularina es + 168,2 °.[2] Es también una molécula muy tensa. El anillo para sustituido de fenol se dobla alrededor de 15° fuera de la planaridad, con la adopción de una cierta geometría similar a un barco. Este tipo de tensión angular en compuestos aromáticos está normalmente reservado para los ciclofanos sintéticos.
 Riccardin C, representación de la molécula plana
Riccardin C, representación de la molécula plana
| Cavicularina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
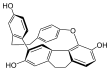
| 9,10,18,19-Tetrahidro-5,8:15,17-dietenobenzo [g]naft[1,8-bc] oxaciclotetradecin-3,12,21-triol | ||
| General | ||
| Fórmula estructural |
 | |
| Fórmula molecular |
C 28H 22O 4 | |
| Identificadores | ||
| Número CAS | 178734-41-3[1] | |
| ChemSpider | 26323925 | |
|
c1cc2ccc1CCc3cc(ccc3-c4c(ccc5c4-c6cc(c(cc6CC5)O)O2)O)O
| ||
| Propiedades físicas | ||
| Masa molar | 42 247 g/mol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Síntesis total
En 2005 y de nuevo en 2011, el compuesto se preparó mediante síntesis total junto con el compuesto ricardina C.[3][4] La estrategia utilizada fue una reacción radicalaria. En 2013 se ha informado de varios procedimientos, uno basado en transanulación,[5] que se basa en una reacción de Diels-Alder[6] y uno (racémico), basado en una reacción de acoplamiento.[7]
Referencias
- Número CAS
- M. Toyota, T. Yoshida, Y. Kan, S. Takaoka, Y. Asakawa (1996). «(+)-Cavicularin: A Novel Optically Active Cyclic Bibenzyl-Dihydrophenanthrene Derivative from the Liverwort Cavicularia densa Steph». Tetrahedron Letters 37 (27): 4745-4748. doi:10.1016/0040-4039(96)00956-2. Archivado desde el original el 18 de julio de 2007. Consultado el 25 de diciembre de 2014.
- David C. Harrowven, Timothy Woodcock , Peter D. Howes (2005). «Total Synthesis of Cavicularin and Riccardin C: Addressing the Synthesis of an Arene That Adopts a Boat Configuration». Angewandte Chemie 44 (25): 3899-3901. PMID 15900530. doi:10.1002/anie.200500466. Archivado desde el original el 10 de diciembre de 2012. Consultado el 25 de diciembre de 2014.
- Kostiuk, S. L., Woodcock, T., Dudin, L. F., Howes, P. D. and Harrowven, D. C. (2011), Unified Syntheses of Cavicularin and Riccardin C: Addressing the Synthesis of an Arene Adopting a Boat Configuration. Chemistry - A European Journal, 17: 10906–10915. doi 10.1002/chem.201101550
- Takiguchi, H., Ohmori, K. and Suzuki, K. (2013), Synthesis and Determination of the Absolute Configuration of Cavicularin by a Symmetrization/Asymmetrization Approach. Angew. Chem. Int. Ed., 52: 10472–10476. doi 10.1002/anie.201304929
- Total Synthesis of (±)-Cavicularin: Control of Pyrone Diels–Alder Regiochemistry Using Isomeric Vinyl Sulfones Peng Zhao and Christopher M. Beaudry Organic Letters 2013 15 (2), 402-405 doi 10.1021/ol303390a
- Kenichi Harada, Kosho Makino, Naoki Shima, Haruka Okuyama, Tomoyuki Esumi, Miwa Kubo, Hideaki Hioki, Yoshinori Asakawa, Yoshiyasu Fukuyama, Total synthesis of riccardin C and (±)-cavicularin via Pd-catalyzed Ar–Ar cross couplings, Tetrahedron, Volume 69, Issue 34, 26 August 2013, Pages 6959-6968, ISSN 0040-4020, http://dx.doi.org/10.1016/j.tet.2013.06.064.
Enlaces externos
- Esta obra contiene una traducción derivada de «Cavicularin» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.