Ciclohepteno
El ciclohepteno es un cicloalqueno de 7 elementos con un punto de inflamación de −6,7 °C. Es una materia prima en química orgánica y un monómero en síntesis de polímeros. El ciclohepteno puede existir como isómero cis o trans.


cis-Ciclohepteno trans-Ciclohepteno
| Ciclohepteno | ||
|---|---|---|
| General | ||
| Fórmula estructural |
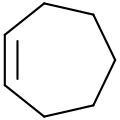 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 628-92-2[1] | |
| ChemSpider | 11857 | |
| PubChem | 12363 | |
| Propiedades físicas | ||
| Masa molar | 96,0939 g/mol | |
trans-Ciclohepteno
Siempre se asume el isómero cis del ciclohepteno, pero el isómero trans también existe. Un procedimiento para la síntesis orgánica de trans-ciclohepteno se da por fotosensibilización del singlete de cis-ciclohepteno con benzoato de metilo y luz ultravioleta a -35 °C. El doble enlace en el isómero trans es muy tenso. Los átomos unidos directamente en un alqueno simple son todos coplanares. En el trans-ciclohepteno , sin embargo, el tamaño del anillo hace que sea imposible esta geometría porque el alqueno y sus dos carbonos unidos a tienen porque los tres carbonos restantes no pueden llegar lo suficientemente lejos para cerrar el anillo (véase también la regla de Bredt). Tendría que haber ángulos inusualmente grandes (tensión angular), longitudes de enlace inusualmente largas, o los átomos del aro tipo alcano colisionarían con la parte alqueno (tensión estérica). Parte de la tensión se alivia mediante la piramidalización de cada carbono del alqueno y su rotación mutua. El ángulo de piramidalización se estima en 37° (en comparación con un ángulo de 0° para un átomo con geometría trigonal-plana normal) y la desalineación del orbital p es de 30,1°. Dado a que la barrera para la rotación del doble enlace en el etileno es de aproximadamente 65 kcal/mol (270 kJ/mol) y solo puede reducirse mediante la energía de deformación estimada de 30 kcal/mol (125 kJ/mol) presente en el isómero trans, el trans-cicloheptenp debe ser una molécula estable al igual que su homólogo, el trans-cicloocteno. De hecho, no lo es: a menos que la temperatura se mantenga muy baja, se produce una isomerización rápida al isómero cis . El mecanismo de esta isomerización no es una simple rotación del enlace alqueno, sino más bien una vía alternativa de menor energía. Sobre la base de las cinéticas de reacción de segundo orden observadas experimentalmente para la isomerización, en la vía propuesta dos moléculas de trans-ciclohepteno primero forman un dirradical dímero. Los dos anillos radicales de heptano se desenrollan después para obtener una conformación sin tensión, y finalmente el dímero se fragmenta de nuevo en dos moléculas de cis-ciclohepteno. Hay que tener en cuenta que la fotoisomerización del ácido maleico a ácido fumárico con bromo también es bimolecular.
Referencias
- Número CAS
- Cycloheptene at Sigma-Aldrich
- Cain, D.; Pawar, D. M.; Noe, E. A. (April 2004). «Conformational studies of trans-cycloheptene, trans-cycloheptene oxide, and trans-bicyclo[5.1.0]octane by ab initio calculations». Journal of Molecular Structure: THEOCHEM 674 (1–3): 251-255. doi:10.1016/S0166-1280(03)00367-1.
- Squillacote, Michael E.; DeFellipis, James; Shu, Qingning (2005). «How Stable Is trans-Cycloheptene?». J. Am. Chem. Soc. 127 (45): 15983-15988. doi:10.1021/ja055388i.