Clorato de potasio
El clorato de potasio o clorato potásico es una sal formada por el anión clorato y el catión potasio. En su forma pura forma cristales blancos. Es el clorato más común en la industria, y se encuentra en la mayoría de los laboratorios. Se emplea mayormente como oxidante, para realizar trabajos de pavonado y en la elaboración de pirotecnia y explosivos.
| Clorato de potasio | ||
|---|---|---|
 | ||
| Nombre IUPAC | ||
| Trioxoclorato (V) de potasio | ||
| General | ||
| Otros nombres |
Clorato potásico Clorato de potasio | |
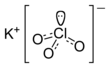
| Fórmula estructural |
 | |
| Fórmula molecular | KClO3 | |
| Identificadores | ||
| Número CAS | 3811-04-9[1] | |
| Número RTECS | FO0350000 | |
| ChEMBL | CHEMBL3188561 | |
| ChemSpider | 18512 | |
| PubChem | 6426889 | |
| UNII | H35KS68EE7 | |
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 2.32 × 10³ kg/m³; 2,32 g/cm³ | |
| Masa molar | 122,55 g/mol | |
| Punto de fusión | 629 K (356 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 7.31 g/100 ml | |
| Peligrosidad | ||
| NFPA 704 |
0
2
3
OX
| |
| Compuestos relacionados | ||
| Aniones relacionados |
KBrO3 KIO3 | |
| Cationes relacionados |
NH4ClO3 NaClO3 | |
| Otros compuestos |
KCl KClO KClO2 KClO4 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El clorato de potasio por sí mismo es seguro a temperatura ambiente, sin embargo mezclado con materiales reductores o combustibles puede volverse sensible a la temperatura, y junto a elementos como el azufre y el fósforo se vuelve inestable, detonándose con la fricción o choque, por lo que fue utilizado para rellenar cápsulas fulminantes, y para su uso en elaboración de pirotecnia fue mayormente relegado por el perclorato de potasio, de mayor estabilidad.
