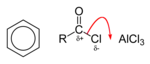Cloruro de acilo
En química orgánica, un cloruro de acilo (o cloruro de ácido) es un compuesto orgánico con el grupo funcional -CO-Cl. Su fórmula suele ser escrita como RCOCl, donde R es una cadena lateral. Se les suele considerar como reactivos derivados de los ácidos carboxílicos. Un ejemplo específico de un cloruro de acilo es el cloruro de acetilo, CH3COCl. Los cloruros de acilo son la subfamilia más importante de los halogenuros de acilo, a la que también pertenece, por ejemplo, el bromuro de acetilo.


cloruro de acetilo o cloruro de etanoílo
Nomenclatura
Cuando la entidad cloruro de acilo tiene la prioridad, los cloruros de acilo son nombrados tomando el nombre del ácido carboxílico padre, y sustituyendo ácido -ico por cloruro -ilo. Entonces:
- cloruro de acetilo CH3COCl
- cloruro de benzoílo C6H5COCl
Cuando otros grupos funcionales tienen la prioridad, se toma a los cloruros de acilo como prefijos -clorocarbonil-:[1]
- ácido (clorocarbonil)acético ClOCCH2COOH
NOMBRE RADICAL ILO
Propiedades
Al carecer de la habilidad para formar enlaces de hidrógeno, los cloruros de acilo tienen puntos de ebullición y fusión menores que los ácidos carboxílicos similares. Por ejemplo, el ácido acético hierve a 118 °C, mientras que el cloruro de acetilo hierve a 51 °C. Como muchos compuestos carbonílicos, la espectroscopia infrarroja revela una banda cerca a 1750 cm−1.
Síntesis
Rutas industriales
La ruta industrial al cloruro de acetilo involucra la reacción del anhídrido acético con el cloruro de hidrógeno. Para el cloruro de benzoílo, es muy útil la hidrólisis parcial del benzotricloruro:[2]
- C6H5CCl3 + H2O → C6H5C(O)Cl + 2HCl
Métodos de laboratorio
En el laboratorio, los cloruros de acilo son preparados generalmente de la misma manera que los cloruros de alquilo, reemplazando los correspondientes sustituyentes hidroxi por cloruros. Entonces, los ácidos carboxílicos se tratan con cloruro de tionilo (SOCl2), tricloruro de fósforo (PCl3), o pentacloruro de fósforo (PCl5):[3]
- RCOOH + SOCl2 → RCOCl + SO2 + HCl
- 3 RCOOH + PCl3 → 3 RCOCl + H3PO3
- RCOOH + PCl5 → RCOCl + POCl3 + HCl
La reacción con cloruro de tionilo puede ser catalizada por dimetilformamida.[4] En esta reacción, el dióxido de azufre (SO2) y el cloruro de hidrógeno (HCl) generados son gases, y salen del reactor, llevando la reacción hacia el cloruro de acilo. El exceso de cloruro de tionilo (p.e. 79 °C) también se evapora fácilmente.[3] Los mecanismos de reacción que involucran al cloruro de tionilo y el pentacloruro de fósforo son similares; el mecanismo con el cloruro de tionilo es ilustrativo:[4]
Otro método involucra el uso de cloruro de oxalilo:
- RCOOH + ClCOCOCl → RCOCl + CO + CO2 + HCl
La reacción es catalizada por dimetilformamida (DMF), que reacciona con el cloruro de oxalilo en un primer paso para generar un intermediario iminio.
El intermediario iminio reacciona con el ácido carboxílico, abstrayendo un óxido, y regenerando el catalizador DMF.[4]
Finalmente, también se conocen métodos que no forman HCl, como la reacción de Appel:[5]
- RCOOH + Ph3P + CCl4 → RCOCl + Ph3PO + HCCl3
y el uso de triclorotriazina (C3N3Cl3):[6]
Reacciones
Reacciones nucleofílicas
Los cloruros de acilo son muy reactivos. Considere la comparación con su análogo ácido RCOOH: el ion cloruro es un excelente grupo saliente, mientras que el ion hidróxido no lo es en condiciones normales; esto es, incluso nucleófilos débiles atacan al carbonilo.
Una reacción común es con el agua, conduciendo al ácido carboxílico:
- R-COCl + H2O → R-CO2H + HCl
Los cloruros de acilo pueden ser usados para preparar derivados de ácido carboxílico, incluyendo anhídridos de ácido, ésteres y amidas, haciendo reaccionar los cloruro de ácido con: una sal de ácido carboxílico, un alcohol, o una amina, respectivamente. Es recomendable el uso de una base, por ejemplo, hidróxido de sodio acuoso o piridina,[3] o amina en exceso (cuando se preparan amidas)[4] para eliminar el producto cloruro de hidrógeno, y catalizar la reacción. Aunque es posible obtener ésteres o amidas de ácidos carboxílicos con alcoholes o aminas, estas reacciones son reversible, por lo que frecuentemente conducen a rendimientos bajos. En contraste, las dos reacciones involucradas en preparar ésteres y amidas usando cloruros de acilo (formación del cloruro de acilo a partir del ácido carboxílico, seguido por condensación con el alcohol o amina) son rápidas y esencialmente irreversibles. Esto hace que la ruta de dos pasos frecuentemente sea preferida a la reacción en un solo paso con el ácido carboxílico.[3]
Ejemplo: La reacción con una amina primaria obteniendo una amida N-sustituida:
- R-COCl + R'-NH2 → R-CO-NH-R' + HCl
Con nucleófilos de carbono, tales como los reactivos de Grignard, los cloruros de acilo reaccionan generalmente primero para producir la cetona, y luego con un segundo equivalente para formar el alcohol terciario. Una excepción notable es la reacción de los halogenuros de acilo con ciertos reactivos de organocadmio, que se detiene en la etapa de cetona. La reacción nucleofílica con los reactivos de Gilman (compuestos de dialquilcobre y litio) también conduce a cetonas, debido a su menor reactividad.[3] Los cloruros de ácido de ácidos aromáticos son generalmente menos reactivos que los de ácidos alquílicos, y por tanto se requieren condiciones más rigurosas para reacción.
Los cloruros de acilo se reducen por donantes de hidruro fuertes, tales como el hidruro de aluminio y litio y el hidruro de diisobutilaluminio para producir alcoholes primarios. El hidruro de tri-tert-butoxialuminio y litio, un voluminoso donante de hidruro, reduce los cloruro de acilo a aldehídos, como también lo hace la reducción de Rosenmund usando gas hidrógeno sobre un catalizador de paladio envenenado.[7]
Reacciones electrofílicas
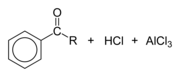
Con catalizadores del tipo ácido de Lewis, como el cloruro de hierro(III) o el cloruro de aluminio, los cloruros de acilo participan en acilaciones de Friedel-Crafts, para producir aril cetonas:[3]
El primer paso es la disociación del cloruro orgánico inducida por el ácido de Lewis:
Este paso es seguido por el ataque nucleofílico del areno hacia el grupo acilo:
Finalmente, un átomo de cloro se combina con el protón liberado para formar HCl, y se regenera el catalizador de Lewis:
Debido a las duras condiciones y a la reactividad de los intermediarios, esta reacción que podría ser útil tiende a complicarse con subproductos, además de ser tóxica a la salud y al medio ambiente
Peligros
Debido a que los cloruros de acilo son compuestos tan reactivos, debe tomarse precauciones al manipularlos. Son lacrimógenos debido a que pueden reaccionar con el agua de la superficie del ojo liberando ácido clorhídrico y ácidos orgánicos que irritan al ojo. Pueden darse problemas similares si se inhalan los vapores de cloruros de acilo.
Referencias
- Nomenclatura de Química Orgánica, R-5.7.6 Acid halides
- Takao Maki, Kazuo Takeda “Benzoic Acid and Derivatives” Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi 10.1002/14356007.a03_555 10.1002/14356007.a03_555
- Boyd, Robert W.; Morrison, Robert (1992). Organic chemistry. Englewood Cliffs, N.J: Prentice Hall. pp. 666-762. ISBN 0-13-643669-2.
- Clayden, Jonathan (2001). Organic chemistry. Oxford: Oxford University Press. pp. 276–296. ISBN 0-19-850346-6.
- "Triphenylphosphine-carbon tetrachloride Archivado el 23 de marzo de 2010 en Wayback Machine. Taschner, Michael J. e-EROS: Encyclopedia of Reagents for Organic Synthesis, 2001
- K. Venkataraman, and D. R. Wagle (1979). «Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides». Tet. Lett. 20 (32): 3037-3040. doi:10.1016/S0040-4039(00)71006-9.
- William Reusch. «Carboxylic Acid Derivatives». VirtualText of Organic Chemistry. Michigan State University. Archivado desde el original el 16 de mayo de 2016.