Coccidioidomicosis
La coccidioidomicosis (también llamada fiebre de San Joaquín o fiebre del Valle) es una enfermedad tratable secundaria a la infección por los hongos dimórficos del género Coccidioides (C. immitis y C. posadasii) que afecta tanto a humanos como animales. Esta entidad nosológica se presenta en zonas semidesérticas, predominantemente en la frontera entre Estados Unidos y México, Centroamérica y Sudamérica, con particular presencia en Argentina y Paraguay. La infección ocurre en individuos que realizan actividades en las que se tiene contacto con la tierra, como agricultura, minería, construcción o inmigración. Si bien la mayoría presenta signos o síntomas respiratorios, las manifestaciones dermatológicas son posibles, los cuales pueden resolverse o conducir a la cronicidad y generalización, especialmente en individuos con algún tipo de inmunodeficiencia.[1]
| Coccidioidomicosis | ||
|---|---|---|
 Cambios histopatológicos en un caso de coccidioidomicosis de pulmón, con un nódulo fibrocaseoso grande. | ||
| Especialidad |
Infectología Neumología Dermatología | |
| Tipos |
Primaria (pulmonar, 98 %; cutánea, 2 %) Residual Secundaria o progresiva (pulmonar, meníngea o cutánea) Generalizada | |
| Causas | Infección por Coccidioides immitis o Coccidioides posadasii | |
| Diagnóstico |
Examen directo de muestras de lesiones Cultivo Biopsia Pruebas inmunológicas Radiografías y tomografía computarizada | |
| Prevención | Fumigación con 1-cloro-2-nitropropano en el suelo contaminado | |
| Tratamiento |
Anfotericina Ketoconazol y otros antimicóticos | |
| Frecuencia |
Valle de San Joaquín: 53.9-150 casos por 100 000 habitantes. México: 0.5-2.6 por 100 000 habitantes (zonas endémicas); 500 casos nuevos. | |
| Sinónimos | ||
|
Fiebre del Valle de San Joaquín Enfermedad del Valle de San Joaquín Fiebre del Valle Enfermedad de Posadas-Wernicke Enfermedad de Posadas Enfermedad de Wernicke Fiebre del desierto Reumatismo del desierto Granuloma coccidioidal Coccidiomicosis (incorrecto) | ||
Epidemiología
Exclusivamente presente en el Hemisferio Occidental entre las latitudes 40° N y 40° S. Es característico de suelos zonas áridas y semiáridas. Coccidioides immitis se encuentra distribuido exclusivamente en el Valle de San Joaquín en el sur de California; mientras que Coccidioides posadasii en el resto de las áreas endémicas conocidas en Arizona y Texas en Estados Unidos; en los estados de Sonora, Nuevo León, Coahuila y Baja California en México,[2] y en regiones de Centroamérica y Sudamérica. Los suelos donde se desarrollan normalmente son alcalinos. En general, el hongo se encuentra en el suelo a 20-25 cm de la superficie (muy frecuente en cuevas de roedores y enterramientos indios donde aparentemente los residuos nitrogenados existentes favorecen su desarrollo). Se requiere una corta estación de lluvias para estimular el crecimiento de la forma micelial. El retorno a las condiciones de sequía y viento son necesarios para que se produzca la amplia diseminación de las artrosporas producidas.[3]
Aunque esta enfermedad no es contagiosa entre individuos ni a través de vectores, su presentación suele ser esporádica, en ocasiones pueden producirse brotes epidémicos en las zonas endémicas asociados a factores que favorezcan la diseminación de las artrosporas. Esta diseminación puede relacionarse con factores naturales (tormentas de polvo, temblores de tierra, fallas de terreno) o antropogénicos (construcciones, excavaciones arqueológicas, prácticas militares). En este sentido fueron muy característicos los brotes epidémicos acaecidos durante II Guerra mundial como consecuencia de la instalación de campos de vuelo militar en el sur de Estados Unidos (incidencia entre el 8-25% de los militares siendo la principal causa de hospitalización), y los producidos en el terremoto de San Francisco.
Antecedentes
Su estudio se remonta a 1892, cuando Posadas y Wernicke describieron el caso de un soldado argentino con lesiones faciales y posterior diseminación. Dos años después, se aisló el agente causal (Coccidioides immitis) de las lesiones de un inmigrante portugués dedicado a las labores agrícolas en el valle de San Joaquín, California, Estados Unidos.[4]
En México, el primer caso importado proveniente de Estados Unidos se registró en 1932; por otra parte, el primer caso autóctono se registró en el territorio de Sonora, en 1948.[4]
Etiología
Solo se han identificado dos especies hasta el momento: Coccidioides immitis (especie "californiana")[5] y Coccidioides posadasii (especie "no californiana"[5]), que encuentran relacionados con el hongo no patógeno Uncinocarpus reesii, miembro de la subclase Ascomycota, orden Onugenales, familia Onygenaceae, del cual solo se distinguen genéticamente por cinco pares de bases de ADN.[1]
Su forma saprofítica miceliana crece en suelos semidesérticos ricos en sales y materia orgánica de norte, centro y sur del continente americano. El micelio al madurar forma en células alternas artrosporas en forma de tonel, de 3 x 6 μm y pared gruesa, que son las formas infectantes. El cultivo de éstas o de las endosporas procedentes de material patológico en SDA a 24 °C, produce colonias micelianas, brillantes, grises y húmedas al principio, luego blancas y algodonosas o afieltradas o que al madurar dan enormes cantidades de artrosporas infecciosas. A diferencia de otros dimórficos, no presenta fase levaduriforme a 37 °C en Agar BHI-Sangre-Cisteína.
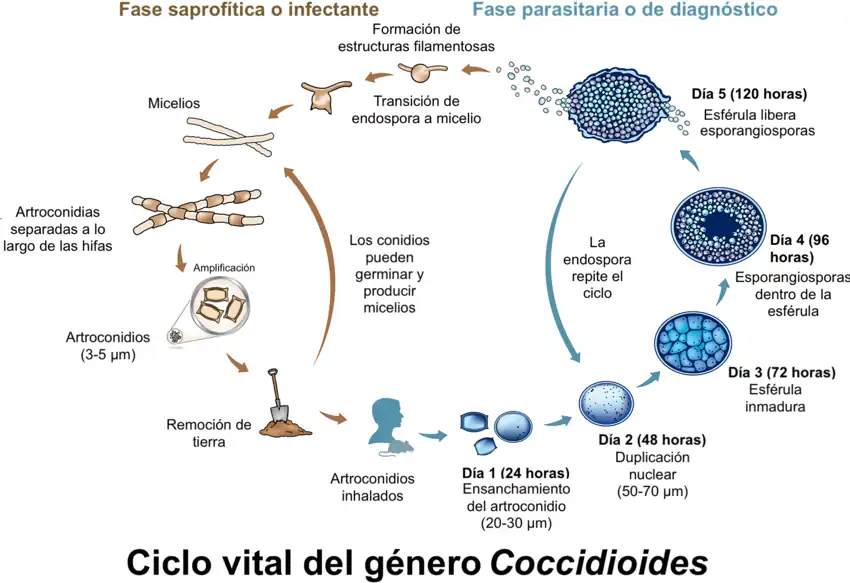
Patogenia
El contagio se produce tras la inhalación de las artrosporas. Son sensibles los mamíferos como el perro, el caballo, primates y el hombre. Se tiene registro de infección en reptiles.
La inhalación y deposición en el alvéolo pulmonar de las artrosporas es seguida de su ingestión por los macrófagos, cuya actividad fagocitaria resisten. Una vez en el seno del tejido pulmonar, la artrospora se hidrata y aumenta isotrópicamente de tamaño mientras sufre una replicación nuclear masiva hasta formar un cenocito de unos 60 μm, seguida de endosporulación por segmentación centrípeta. La esférula gigante madura contiene entre 200-300 endosporas que comienzan a crecer isotrópicamente y que se liberan al estallar la esférula madre.
Las endosporas pueden formar nuevas esférulas y colonizar otros tejidos por contigüidad, vía linfohemática, o transportadas por fagocitos, pero muy a menudo la infección inicial activa los macrófagos y la liberación de las endosporas desencadena una respuesta inflamatoria intensa y eficaz, que aborta la infección en este punto, dejando una inmunidad permanente.
Si la inmunidad celular no es eficaz, la evolución es granulomatosa, más proliferativa en animales y más exudativa en humanos. En algunos casos puede quedar latente la infección, mientras en otros la enfermedad progresa, extendiéndose por pulmón y a otros tejidos, especialmente óseo, cutáneo y subcutáneo, y meníngeo en humanos. Puede haber transmisión transplacentaria en hembras gestantes. La infección siempre es sensibilizante; las formas progresivas pueden ser más o menos agudas, pero tienden a ser mortales.
Cuadro clínico
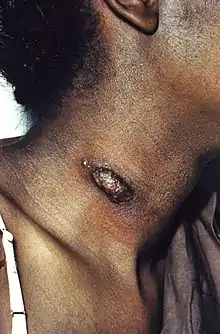

La infección inicial puede pasar desapercibida o cursar con ligeros síntomas gripales. Las formas progresivas cursan con tos y disnea persistente, debilidad, depresión, fiebre intermitente y pérdida de peso. Después se puede producir osteomielitis con cojeras, abscesos y aborto en hembras gestantes. Agudas o crónicas, las formas progresivas no tratadas son mortales.
Lesiones
- Las lesiones macroscópicas son de tamaño variable y aspecto tuberculoide, bastante sólidas de textura y con cierta tendencia a la supuración. Las lesiones óseas tienden a situarse en epífisis y uniones osteocondrales, y suelen desarrollar tractos fistulosos hacia el exterior.
- Microscópicamente son granulomas extensos, ricos en macrófagos, polimorfonucleares y linfocitos, y con poca tendencia a la fibrosis ni la caseificación, envolviendo esférulas en diversos estadios de madurez y endosporas libres o fagocitadas, también frecuentes en los exudados.
Diagnóstico
- Clínico-epidemiológico: bastante característico, teniendo en cuenta la procedencia o estancia en zonas enzoóticas y el cuadro respiratorio progresivo.
- Lesional: patognomónico a escala microscópica, no es tan característico el macroscópico, que se puede confundir con blastomicosis e histoplasmosis. Histológicamente las lesiones más comunes (34 %) son los granulomas supurativos, sin excluir la presencia de infiltrado linfoplasmocitario, granuloma sarcoidal, inflamación linfoplastrofílica, granuloma necrotizante e inflamación eosinofílica.[1]
- Micológico: la presencia de esférulas y endosporas en extensiones y frotis de exudados aclarados con KOH es difícil de confundir con otras micosis, aunque no tanto con prototecosis. La falta de crecimiento en Agar BHI-Sangre-Cisteína a 37º es también característica; en cambio el cultivo en SDA a 25 °C no debe intentarse sin grandes medidas de seguridad ni por personal inexperto, dada la gran producción y peligrosidad de las artrosporas. Todos los cultivos deben manejarse con la máxima precaución y los confirmados ser esterilizados cuanto antes. Las artrosporas de pared gruesa en forma de tonel, alternando con células colapsadas aún en el micelio, o con faldillas en los extremos procedentes de las mismas, son prácticamente diagnósticas. Existen sondas comerciales de ADN para hibridación, utilizables directamente sobre material patológico.
- Inmunológico: los extractos acuosos de cultivos sospechosos se pueden identificar en IDGA con sueros positivos, y la coccidioidina (extracto acuoso titulado y estandardizado), se puede usar como tanto como alérgeno (positivo en todos los expuestos, y da reacciones cruzadas) en pruebas cutáneas como para antígeno en IDGA frente a sueros problema. También se utilizan técnicas serológicas de fijación de complemento y aglutinación con látex; todas ellas pueden dar reacciones cruzadas con histoplasmosis y blastomicosis.
Tratamiento
Ante el elevado riesgo de infección en áreas endémicas y la peligrosidad de ésta, cada vez hay mayor demanda de vacunas eficaces (la infección subclínica inmuniza). El diagnóstico precoz y tratamiento con imidazoles sistémicos o anfotericina B pueden ser eficaces, pero deben ser muy prolongados. En personas es posible la prevención pasiva en trabajos arriesgados mediante mascarillas.
Aspectos zoonósicos
El hombre es sensible a la coccidiodomicosis, y aunque cualquiera está expuesto a la infección inhalatoria en las zonas endémicas, dada la frecuencia con que se encuentra en el polvo, tiene un cierto carácter profesional, afectando sobre todo a cavadores, agricultores, ganaderos y arqueólogos. Mongoloides y negros son más sensibles que los blancos. Es un proceso emergente muy peligroso entre inmunodeprimidos. También están expuestos médicos, veterinarios y trabajadores de laboratorio. De hecho se ha desistido de utilizar Coccidioides immitis como arma biológica por ser demasiado peligroso para los manipuladores, pues las artrosporas pueden cruzar filtros de 2 μm.
Guerra biológica
C. immitis fue investigada por EE. UU. durante los 1950s y 1960s como un arma biológica. La "raza Cash" recibió el "símbolo militar" "OC", y la esperanza original era respecto de su capacidad incapacitante. Luego la evidencia médica epidemiológica, demostró más tarde, que OC podría tener efectos letales en varios segmentos de la población, por lo que fue recatalogado de "agente letal". Nunca fue estandarizado, y se llevaron a cabo pocos ensayos a campo, y nunca fue puesta "en servicio". Muchos de los estudios militares sobre OC fueron sobre vacunas a mediados de los 1960s.
Referencias
- Trujillo Bonifaz, J. Alexandro (2012) [1990]. «Coccidioidomicosis». Micología médica básica (4ª edición). McGRAW-HILL INTERAMERICANA EDITORES. pp. 262-278. ISBN 978-607-15-0744-0.
- Baptista-Rosas, Riquelme M, Hinojosa A. Ecological niche modeling of Coccidioides spp. in Western North American deserts. Ann N Y Acad Sci. 2007;1111:35-46.
- Baptista-Rosas RC, Arellano E, Hinojosa A, Riquelme M. Bioclimatología de la Coccidioidomicosis en Baja California, México. Investigaciones Geográficas, Boletín del Instituto de Geografía, UNAM 2010; 71: 21-30.
- Verduzco G., E. (10 de noviembre de 2014). «Epidemiología de la coccidioidomicosis en México.». Salud Pública Mex XIII (1): 23-31. Consultado el 3 de octubre de 2020.
- Laniado-Laborín, Rafael (2006). «Coccidioidomicosis: Más que una enfermedad regional». Revista del Instituto Nacional de Enfermedades Respiratorias 19 (4): 301-308. Archivado desde el original el 13 de octubre de 2020. Consultado el 11 de octubre de 2020.
Enlaces externos
- Una revisión sobre la coccidioidomicosis
- Coccidioidomicosis en una excavación arqueológica
- Coccidioidomicosis producida por una tormenta de polvo
- http://www.nlm.nih.gov/medlineplus/spanish/ency/article/001322.htm
- http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000096.htm
- http://www.shands.org/health/spanish/esp_ency/article/001322.htm