Cooperatividad
Este artículo está escrito en el contexto de la biología molecular. El mismo tipo de fenómeno -una transición entre dos estados influida por una transición análoga en un sistema vecino, que se traduce en histéresis- se produce también en otros contextos científicos, como en magnetismo.
La cooperatividad o unión cooperativa es un fenómeno biológico producida por enzimas o receptores que presentan diversos sitios de unión. También se da cooperatividad en moléculas con largas cadenas formadas por subunidades idénticas o casi idénticas (como por ejemplo DNA, proteínas y fosfolípidos) cuando estas moléculas sufren cambios de fase como cuando se funden o se despliegan. Esto se conoce como subunidad cooperativa.
Unión cooperativa
Cuando un sustrato se une a una subunidad enzimática, el resto de las subunidades son estimuladas y se activan. Los ligandos pueden tener cooperatividad positiva, cooperatividad negativa o no cooperatividad.
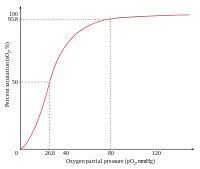
Un ejemplo de cooperatividad positiva es la unión del oxígeno con la hemoglobina. Una molécula de oxígeno se puede unir con el hierro (II) en el anillo porfirínico de una molécula hemo en cada una de las cuatro cadenas de la molécula de hemoglobina. La desoxihemoglobina tiene una relativa baja afinidad para el oxígeno, pero cuando una molécula se une a un único hemo, crece la afinidad por el oxígeno, permitiendo que la segunda molécula se una más fácilmente, y la tercera y cuarta aún más fácilmente. La afinidad del oxígeno con la 3-oxi-hemoglobina es aproximadamente unas trescientas veces mayor que con la desoxihemoglobina. Este comportamiento conduce la curva de afinidad de la hemoglobina a ser una curva sigmoidea, más que una hiperbólica como pasa con la mioglobina monomérica. Por el mismo proceso, la habilidad de la hemoglobina para perder oxígeno crece cuantas menos moléculas estén unidas.[2]
La cooperatividad negativa significa lo contrario; cuando el ligando se une a la proteína, la afinidad de la proteína por el ligando se reduce. Un ejemplo de esto ocurre con la relación entre el gliceraldehído-3-fosfato y la enzima gliceraldehído-3-fosfato deshidrogenasa.[3]
La cooperatividad homotrópica se refiere al hecho de que la molécula que causa la cooperatividad es aquella que más tarde sufrirá las consecuencias de esta cooperatividad. La cooperatividad heterotrópica es cuándo una tercera sustancia causa el cambio en la afinidad.
La cooperatividad en la hemoglobina
La hemoglobina es una proteína que contiene dos cadenas α (141 restos) y dos cadenas β (146 restos), a cada una de las cuales se halla unido un resto hemo mediante un enlace no covalente. Estas cadenas en su estructura terciaria son muy semejantes a la de la mioglobina, por lo tanto, la función biológica es semejante en ambas proteínas y su capacidad para unir el oxígeno de modo reversible a los grupos hemo. Son moléculas planas en las cuales los átomos de hierro forman complejos envueltos por los grupos R no polares. El quinto enlace de cada átomo de hierro se establece con un nitrógeno imidazólico de un resto de histidina y la sexta posición queda para una molécula de oxígeno.[4] Mediante la desoxigenación, las cadenas α experimentan una rotación de 9º y las cadenas β de 7º en distintos ejes, cambiando así los puntos de contacto entre las 4 subunidades: los grupos hemo α se aproximan 0,01 nm y los β 0,65 nm. Así en la unión de oxígeno se provoca un cambio en la estructura cuaternaria.[5]
El carácter sigmoidal de la curva de unión al oxígeno de la hemoglobina significa que posee una afinidad relativamente baja para captar la primera o segunda molécula de oxígeno, pero una vez unidas, la unión de las siguientes resulta muy aumentada. En cambio, la pérdida de una molécula de oxígeno a la hemoglobina oxigenada provoca que el resto se disocie más fácilmente al bajar la presión de oxígeno.[6]
Con el pH también se afecta al equilibrio, contra mayor es el pH a una determinada presión con el oxígeno, mayor es el porcentaje de saturación con el O2.[7] Esto se debe a que cuando la hemoglobina se oxigena, queda ionizada y deja libre un H+ por cada molécula de oxígeno unida.
La presión parcial de oxígeno y el pH (efecto Bohr) son dos factores que regulan la función de la hemoglobina en el transporte de oxígeno.
Se han propuesto dos modelos generales para interpretar las interacciones entre subunidades durante la oxigenación de la hemoglobina. Los dos modelos suponen que cada una de las subunidades de la molécula de hemoglobina pueden existir dos conformaciones distintas: una con afinidad elevada y la otra con afinidad inferior por el oxígeno.
El primer modelo, propuesto por G. Adair, conocido como modelo secuencial expone que cuando se une una molécula de oxígeno a una subunidad, esta cambia su conformación, adoptando la forma de afinidad elevada, la que con contactos con las otras subunidades incrementa la probabilidad de que la siguiente subunidad se desplace hacia la forma de alta afinidad y capte la molécula de oxígeno siguiente. El punto clave del modelo secuencial es la existencia de estados de conformación intermedios.[8] El otro modelo, el modelo simétrico descrito por J. Monod, J. Wyman y J. P. Changeux, postula que la molécula de hemoglobina existe sólo en dos formas: la de baja afinidad y la de alta afinidad. En este modelo, la molécula de hemoglobina es siempre simétrica, es decir, que todas las subunidades se hallan en un estado o en otro.[9]
Petruz ha postulado que los primeros oxígenos se unen a las subunidades α, modificando sus interacciones iónicas con las subunidades β y provocando la liberación de protones del efecto Bohr. Las cuatro subunidades se desplazan hacia la forma de alta afinidad. Las restantes subunidades unen O2 con afinidad elevada y liberan otros dos protones.
Cooperatividad entre subunidades
La cooperatividad no es solo un fenómeno de la unión de ligandos, pero afecta también en cualquier interacción energética haciendo este proceso más fácil o más difícil que suceda incluyendo múltiple unidades como se ha comparado con unidades únicas. Esto es, más fácil o difícil comparado con lo que se puede esperar cuando sólo se unen múltiples unidades. Por ejemplo, el despliegue de DNA incluye cooperatividad. Porciones de DNA se han de separar para que el DNA pueda seguir el proceso de replicación, transcripción y recombinación. La cooperatividad positiva entre nucleótidos adyacentes de nucleótidos de DNA hace más fácil desplegar un grupo entero de nucleótidos adyacentes que si se desplegara el mismo número de nucleótidos repartidos a lo largo de la cadena de DNA.[10] El tamaño de la unidad cooperativa es el número de bases adyacentes que tienden a desplegarse como una única unidad debido a los efectos de la cooperatividad positiva. Este fenómeno también se relaciona a otros tipos de cadenas, como por ejemplo el pliegue y el despliegue de proteínas y cuando se “funden” las cadenas de fosfolípidos que conforman las membranas plasmáticas.
Entropía y cooperatividad
En todos los tipos de cooperatividad anteriormente descritos, la entropía juega un papel importante. Por ejemplo en el caso de la unión del oxígeno con la hemoglobina, el primer oxígeno tiene cuatro distintos lugares donde unirse. Esto representa un estado de alta entropía comparado con la unión del último oxígeno que únicamente tiene un único lugar libre para la unión. Así, el paso de un estado libre a un estado unido, el primer oxígeno ha de superar un cambio de mayor entropía que el último oxígeno.[11] Esta diferencia de entropía es la principal razón por la cual se produce la cooperatividad positiva en la unión del oxígeno con la hemoglobina.
Véase también
Referencias
- Müller-Esterl, W. (2008). "Bioquímica. Fundamentos para medicina y ciencias de la vida", p. 145.
- Alberts, B. (2008). "Molecular Biology of the Cell". Garland Science, New York. 173-174.
- en:Cooperativity
- ALBERTS, Bruce. (2008). "Molecular Biology of the Cell". Garland Science, New York. 256.
- NELSON L, David; M COX, Michael. (2009) "Lehninger. Principios de Bioquímica". Editorial Omega, Barcelona. 148-156.
- STRYER, Lubert. (1995). "Bioquímica". Editorial Reverté, Bilbao. 157-159
- STRYER, Lubert. (1995). "Bioquímica". Editorial Reverté, Bilbao. 160
- STRYER, Lubert. (1995). "Bioquímica". Editorial Reverté, Bilbao. 157-168
- NELSON L, David; M COX, Michael. (2005). "Lehninger. Principios de Bioquímica". Editorial Omega, Barcelona. 148-156.
- ALBERTS, Bruce. (2008). "Molecular Biology of the Cell". 273, 276.
- http://en.wikipedia.org/wiki/Cooperativity