Decacarbonilo de dimanganeso
El decacarbonilo de dimanganeso es un compuesto organometálico con la fórmula química Mn2(CO)10. Disponible comercialmente, se utiliza como punto de partida para la síntesis de muchos complejos de manganeso. El compuesto consiste en un par de unidades de Mn(CO)5 unidas mediante un enlace metal-metal (Mn-Mn), que produce un complejo de carbonilo homoléptico.[2]
| Decacarbonilo de dimanganeso | ||
|---|---|---|
10.png.webp) | ||
 | ||
| Nombre IUPAC | ||
| Bis-pentacarbonil-manganeso (0) (Mn-Mn) | ||
| General | ||
| Otros nombres | Decacarbonilo de manganeso | |
| Fórmula semidesarrollada | Mn2(CO)10 | |
| Fórmula molecular | Mn2C10O10 | |
| Identificadores | ||
| Número CAS | 10170-69-1[1] | |
| ChemSpider | 451751 | |
| PubChem | 517769 | |
| Propiedades físicas | ||
| Apariencia | amarillo anaranjado | |
| Densidad | 1750 kg/m³; 1,75 g/cm³ | |
| Masa molar | 38 998 g/mol | |
| Punto de fusión | 427 K (154 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | insoluble | |
| Momento dipolar | 0 D | |
| Peligrosidad | ||
| SGA |
 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Estructura y propiedades
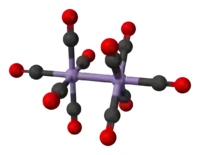
La estructura cristalina de Mn2(CO)10 es relativamente conocida. El compuesto consta de un par de unidades de pirámides de base cuadrada Mn(CO)5, presente en el estado de oxidación 0, unidas por un enlace metal-metal (Mn-Mn), por lo tanto, debe considerarse como clúster metálico según la definición de Cotton. Hay dos tipos de ligandos de CO; un CO en cada átomo de Mn es coaxial con el enlace Mn-Mn (293 pm), y cuatro en cada manganeso que son perpendiculares a él (ecuatoriales). En el rotador estable, las dos subunidades Mn (CO) 5 están alternadas. Por lo tanto, la molécula general pertenece al grupo puntual D4d, que es una simetría poco común compartida con el S2F10. A diferencia de su homólogo el decacarbonilo de dirrenio, la conformación eclipsada no se produce, ya que el radio atómico es muy inferior.[3]
El Mn2(CO)10 cumple la regla de los 18 electrones: Mn(0) tiene 7 electrones externos (2x7=14), cada ligando carbonílico aporta 2 electrones (2x10=20), el enlace metal-metal tiene 2 electrones → 14 + 20 + 2 = 36 (como hay dos núcleos metálicos: 36/2=18).
Síntesis
El decacarbonilo de dimanganeso se puede obtener por carbonilación a presión de sales de manganeso (II), tales como el cloruro de manganeso (II) o el acetato de manganeso (II):[4]
El compuesto se preparó por primera vez con bajo rendimiento mediante la reducción de yoduro de manganeso con magnesio en atmósfera de CO.[5] Una preparación más eficiente implica la reducción de MnCl2 anhidro con cetil benzofenona de sodio bajo 200 atmósferas de CO.[6] La disponibilidad de metilciclopentadienil manganeso tricarbonilo ("MMT") ha llevado a una ruta de baja presión hacia Mn2(CO)10.[7]
Reactividad
El Mn2(CO)10 es estable al aire como un sólido cristalino, pero las disoluciones requieren técnicas de Schlenk. Debido a esto, se encuentra su uso limitado en síntesis orgánica.[8] Sus reacciones características son:
- La reducción de Mn2(CO)10 da el anión manganeso pentacarbonilo, el cual puede ser aislado como una sal:
El anión es un nucleófilo muy versátil. La protonación da el hidruro [HMn(CO)5], y la metilación el [(CH3)Mn(CO)5].
- La bromación del Mn2(CO)10 se produce con escisión del enlace Mn-Mn para dar el bromuro de pentacarbonilo de manganeso.
Seguridad y usos
El decacarbonilo de dimanganeso es una fuente volátil de un metal y una fuente de CO. Es un reactivo de partida para compuestos de carbonilo de manganeso y también se usa como catalizador y agente antidetonante.
Referencias
- Número CAS
- Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 3-527-29390-6
- L. F. Dahl, E. Ishishi, R. E. Rundle "Polynuclear Metal Carbonyls. I. Structures of Mn2(CO)10 and Re2(CO)10 J. Chem. Phys. 1957, volume 26, p. 1750. doi 10.1063/1.1743615
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1634.
- Brimm, E. O.; Lynch, M. A.; Sesny, W. J. "Preparation and Properties of Manganese Carbonyl" Journal of the American Chemical Society 1954, volume 76, page 3831 - 3835.
- King, R. B. Organometallic Syntheses. Volume 1 Transition-Metal Compounds; Academic Press: New York, 1965. ISBN 0-444-42607-8
- King, R. B.; Stokes, J. C.; Korenowski, T. F. "A Convenient Synthesis of Dimanganese Decarbonyl from Inexpensive Starting Materials at Atmospheric Pressure" Journal of Organometallic Chemistry 1968, volume 11, Pages 641-643.
- Pauson, P. L. "Decacarbonyldimanganese" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi 10.1002/047084289X.