Dendrobatidae
Los dendrobátidos (Dendrobatidae) son una familia de anfibios anuros conocidos como ranas venenosas de dardo o ranas punta de flecha, endémicas de Centroamérica y América del Sur, que incluye 203 especies y está estrechamente relacionada con la familia Aromobatidae, con la que forma la superfamilia Dendrobatoidea.
| Ranas punta de flecha | ||
|---|---|---|
 | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Subfilo: | Vertebrata | |
| Clase: | Amphibia | |
| Orden: | Anura | |
| Familia: |
Dendrobatidae Cope, 1865 | |
| Distribución | ||
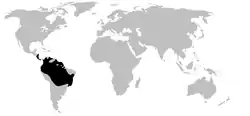 Distribución de Dendrobatidae. | ||
| Géneros | ||
Taxonomía
La familia Dentrobatidae incluye, distribuidos en tres subfamilias, los siguientes géneros:[1][2][3][4]
- Subfamilia Colostethinae Cope, 1867 (67 especies)
- Ameerega Bauer, 1986 (29 especies)
- Colostethus Cope, 1866 (15 especies)
- Epipedobates Myers, 1987 (8 especies)
- Leucostethus Grant, Rada, Anganoy-Criollo, Batista, Dias, Jeckel, Machad & Rueda-Almonacid, 2017 (7 especies)
- Silverstoneia Grant, Frost, Caldwell, Gagliardo, Haddad, Kok, Means, Noonan, Schargel & Wheeler, 2006 (8 especies)
- Subfamilia Dendrobatinae Cope, 1865 (61 especies)
- "Colostethus" ruthveni
- Adelphobates Grant, Frost, Caldwell, Gagliardo, Haddad, Kok, Means, Noonan, Schargel & Wheeler, 2006 (3 especies)
- Andinobates Twomey, Brown, Amézquita & Mejía-Vargas, 2011 (15 especies)
- Dendrobates Wagler, 1830 (5 especies)
- Excidobates Twomey & Brown, 2008 (3 especies)
- Minyobates Myers, 1987 (1 especie)
- Oophaga Bauer, 1994 (12 especies)
- Phyllobates Duméril & Bibron, 1841 (5 especies)
- Ranitomeya Bauer, 1986 (16 especies)
- Subfamilia Hyloxalinae Grant, Frost, Caldwell, Gagliardo, Haddad, Kok, Means, Noonan, Schargel & Wheeler, 2006 (74 especies)
- Ectopoglossus Grant, Rada, Anganoy-Criollo, Batista, Dias, Jeckel, Machado & Rueda-Almonacid, 2017 (7 especies)
- Hyloxalus Jiménez de la Espada, 1870 (64 especies)
- Paruwrobates Bauer, 1994 (3 especies)
- Incertae sedis:
- "Colostethus" poecilonotus
Descripción
Estas ranas se caracterizan popularmente por su piel brillante y coloreada, poseen una coloración aposemática. El rango de colores va del naranja luminoso y negro azulado al amarillo y el rojo. Sin embargo, los miembros del género Colostethus son generalmente castaños y poco llamativos. Las ranas van de un tamaño de 1 a 6 cm de longitud, dependiendo de la edad y la especie de rana.
Distribución y hábitat
Tienen una distribución neotropical que va de Nicaragua a Bolivia, incluyendo la mayor parte del norte de Sudamérica y algunas islas caribeñas. Habitan ecosistemas muy diversos: bosques de nubes, selvas tropicales de tierras bajas, bosques andinos xerofíticos, etc.[5] Su rango altitudinal va de los 300 a los 2000 m.[6] Dendrobates auratus ha sido introducida en las islas Hawái.[7] La diversidad de especies es mayor en Panamá y Costa Rica, el Chocó colombiano, los Andes colombianos y el piedemonte andino oriental de Ecuador y Perú.[8]
Comportamiento

Estas ranas son de hábitos diurnos,[5] y tienen una dieta basada en pequeños artrópodos (hormigas, ácaros, termitas, ortópteros, escarabajos, etc.), que varía mucho entre especies, mientras que algunas son especialistas, otras muchas son generalistas.[9][10] Muestran un comportamiento, especialmente en lo reproductivo, complejo; son especies territoriales y la mayoría suelen exhibir un cuidado parental grande hacia sus huevos y renacuajos.[11][12]
Toxicidad

Estas ranas recibieron su nombre común de los numerosos tipos de alcaloides venenosos encontrados en la piel de muchas especies. Un buen número de los miembros de esta familia poseen en su piel estas defensas químicas. Las pumiliotoxinas son una familia de aproximadamente 80 alcaloides, liposolubles, que lo obtienen de la dieta, principalmente de artrópodos, es decir, que estas toxinas no son sintetizadas por las propias ranas (Saporito et al. 2004, Smith y Jones 2004). La rana dardo más venenosa es la rana dorada (Phyllobates terribilis), la toxina que poseen es la batraciotoxina, la cual penetra en su cuerpo al ingerir un tipo de escarabajos de la familia Melyridae, que son los que la sintetizan, la rana al ingerir este tipo de coleópteros acumulan la toxina en su cuerpo ya que esta no les hace daño.[cita requerida]
Se ha comprobado que los niveles de toxicidad varían dentro de una misma población según como de llamativo es su patrón de coloración. Tradicionalmente y como parecería lógico se ha considerado que los fenotipos con un patrón más llamativo y visible van junto a mayor toxicidad,[13] como se ha demostrado para Oophaga pumilio,[14] pero en contra de esta lógica por ejemplo en O. granulifera se vio que ocurría justo lo contrario, los fenotipos con patrones más apagados tenían mayores niveles de toxicidad.[15] Aunque no está claro, los mecanismos que están detrás de esto podrían ser la disponibilidad de presas, o la dieta entre distintas zonas.[15]
Aposematismo

Tradicionalmente se ha considerado que el aposematismo en Dendrobatidae tenía un único origen evolutivo, ya que los compuestos bioquímicos tóxicos como rasgo son difíciles de elaborar y poco probables de que se den en la evolución, siguiendo así un criterio de máxima parsimonia.[10] Pero los últimos estudios filogenéticos que incluyen caracteres moleculares parecen demostrar que el aposematismo en Dendrobatidae tiene múltiples orígenes,[10][16] en un proceso de convergencia evolutiva que se desarrolló de manera independiente.
El número de veces que este proceso se ha dado es objeto de divergencias entre diferentes estudios, entre tres y cinco para algunos,[10] y en estudios más recientes seis para la coloración de advertencia y cuatro para la toxicidad, habiendo menos orígenes para la toxicidad dado que existen clados de mímicos batesianos de especies tóxicas.[17] La especialización en la dieta también se ha desarrollado en varias ocasiones, entre dos y tres, y parece que de manera muy estrecha a la del aposematismo, aunque hay casos de especies aposemáticas que no presentan una dieta especializada aparente. Estos procesos evolutivos son, a excepción de uno de ellos, bastante recientes.[10][17]
Hay, además, algunos otros rasgos que parecen haber surgido junto al aposematismo y su especialización alimenticia. El primero serían una cabeza y lengua más estrechas para poder alimentarse de especies muy pequeñas como los ácaros. El segundo un aprente metabolismo más rápido, justo lo contrario que otras especies de ranas simpátricas terrestres; aunque se tienen datos de pocas especies.[18] Estos rasgos no son independientes y probablemente se refuercen los unos a los otros, aunque si parece claro que el primero en surgir y comenzar con todo este fenómeno es la toxicidad,.[10] Que rasgos surgen tras la toxicidad no está claro, aunque existen algunas hipótesis al respecto. La primera sería que la coloración aposemática surgiría, aumentaría la capacidad de conseguir recursos del individuo y esto acabaría llevando a tasas metabólicas más altas y a una especialización de la dieta. La segunda sería que la especialización de la dieta iría tras la toxicidad permitiendo que esta aumentara, y facilitando posteriormente la aparición de coloraciones de advertencia. Pero es importante reforzar la idea de que después este conjunto de rasgos han coevolucionado.[10][17] También es importante señalar que si se dieran condiciones en las que la efectividad del aposematismo se redujera la especialización alimenticia podría revertir a una dieta generalista.[17]
Se tiende a considerar que la coloración aposemática está controlada y direccionada por la selección por depredación ya que son ellos, los predadores, los que se encargan de mantener el fenotipo con la señal más efectiva. Pero en el caso de Oophaga pumilio se ha visto que entra en juego la selección sexual, las hembras eligen a los machos con una coloración más brillante, generando un leve dimorfismo sexual.[19] La coloración aposemática también influye en este caso en el comportamiento territorial entre machos.[20]
La selección por depredación funciona como una fuerza estabilizadora de la evolución, manteniendo la señal de advertencia establecida,[21] pero esto parece ser solo así cuando la frecuencia de la señal es alta, es decir cuando el número de individuos que poseen la señal es alto. Si es baja se abre una puerta a que la señal evolucione o surja una nueva.[22] Además, el patrón no influye en la depredación, si no que tiene que ver más con la coloración.[23] En general las señales de advertencia en este clado parecen estar dirigidas a sus depredadores a corta distancia como son serpientes y arañas,[17] aunque para Oophaga pumilio se vio que las señales de advertencia eran honestas para aves, ligeramente para crustáceos y no existía una correlación entre toxicidad y coloración para serpientes,[14] lo que se explica ya que en este caso son las aves el principal depredador.[23]
Referencias
- Frost, D.R. «Dendrobatidae ». Amphibian Species of the World: an Online Reference. Version 6.2. (en inglés). Nueva York, EEUU: Museo Americano de Historia Natural. Consultado el 15 de febrero de 2021.
- Brown JL, Twomey E, Amézquita A, De Souza MB, Caldwell JP, Lötters S, Von May R, Melo-Sampaio PR, Mejía-Vargas D, Perez-Peña P, Pepper M, Poelman EH, Sanchez-Rodriguez M, Summers K 2011 A taxonomic revision of the Neotropical poison frog genus Ranitomeya (Amphibia: Dendrobatidae). Zootaxa 3083: 1-120.
- Diego F. CISNEROS-HEREDIA, Mario H. YANEZ-MUÑOZ 2010 A new poison frog of the genus Epipedobates (Dendrobatoidea: Dendrobatidae) from the north-western Andes of Ecuador. Avances en Ciencias e Ingenierías 2:83-86.
- Vaz-Silva W, Medeiros Maciel N 2011 A new cryptic species of Ameerega (Anura: Dendrobatidae) from Brazilian Cerrado. Zootaxa 2826: 57-68.
- Grant, T. et al., 2006. Phylogenetic Systematics of Dart-Poison Frogs and Their Relatives (Amphibia: Athesphatanura: Dendrobatidae). Bulletin of the American Museum of Natural History, 299(299), pp.1–262.
- Twomey E. & Brown J. Habitat of poison frogs Archivado el 5 de marzo de 2016 en Wayback Machine.(en inglés) Dendrobates.org
- Daly, J.W. et al., 1992 Variability in alkaloid profiles in neotropical poison frogs (Dendrobatidae): genetic versus environmental determinants. Toxicon official journal of the International Society on Toxinology, 30 (8), pp.887-898
- Twomey E. & Brown J. Distribution of poison frogs(en inglés) Dendrobates.org
- Toft, C.A., 1981. Feeding Ecology of Panamanian Litter Anurans: Patterns in Diet and Foraging Mode. Journal of Herpetology, 15(2), pp.139–144.
- Santos, J.C., Coloma, L.A. & Cannatella, D.C., 2003. Multiple, recurring origins of aposematism and diet specialization in poison frogs. Proceedings of the National Academy of Sciences of the United States of America, 100(22), pp.12792–12797.
- Weygoldt, P., 1987. Evolution of parental care in dart poison frogs ( Amphibia: Anura: Dendrobatidae ). Journal of Zoological Systematics and Evolutionary Research, 25(1), pp.51–67.
- Pröhl, H., 2005. Territorial Behavior in Dendrobatid Frogs. Journal of Herpetology, 39(3), pp.354–365.
- Blount, J.D. et al., 2009. Warning displays may function as honest signals of toxicity. Proceedings. Biological sciences / The Royal Society, 276(1658), pp.871–7.
- Maan, M.E. & Cummings, M.E., 2012. Poison frog colors are honest signals of toxicity, particularly for bird predators. The American Naturalist, 179(1), pp.E1–14.
- Wang, I.J., 2011. Inversely related aposematic traits: reduced conspicuousness evolves with increased toxicity in a polymorphic poison-dart frog. Evolution, 65(6), pp.1637–1649.
- Vences, M. et al., 2003. Convergent evolution of aposematic coloration in Neotropical poison frogs: a molecular phylogenetic perspective. Organisms, Diversity & Evolution, 3, pp.215–226.
- Santos, J.C. & Cannatella, D.C., 2011. Phenotypic integration emerges from aposematism and scale in poison frogs. Proceedings of the National Academy of Sciences of the United States of America, 108(15), pp.6175–80.
- Santos, J.C., 2012. Fast molecular evolution associated with high active metabolic rates in poison frogs. Molecular biology and evolution, 29(8), pp.2001–18.
- Maan, M.E. & Cummings, M.E., 2009. Sexual dimorphism and directional sexual selection on aposematic signals in a poison frog. Proceedings of the National Academy of Sciences of the United States of America, 106(45), pp.19072–19077.
- Crothers, L., Gering, E. & Cummings, M., 2011. Aposematic signal variation predicts male-male interactions in a polymorphic poison frog. Evolution; international journal of organic evolution, 65(2), pp.599–605.
- Noonan, B.P. & Comeault, A. a, 2009. The role of predator selection on polymorphic aposematic poison frogs. Biology letters, 5(1), pp.51–54.
- Comeault, A.A. & Noonan, B.P., 2011. Spatial variation in the fitness of divergent aposematic phenotypes of the poison frog, Dendrobates tinctorius. Journal of evolutionary biology, 24(6), pp.1374–1379.
- Hegna, R.H. et al., 2011. Contrasting colors of an aposematic poison frog do not affect predation. Annales Zoologici Fennici, 48, pp.29–38.






