Dicianoacetileno
El dicianoacetileno, también llamado subnitruro de carbono o but-2-ino dinitrilo (IUPAC), es un compuesto de carbono y nitrógeno con la fórmula química C4N2. Tiene una estructura molecular lineal, N≡C−C≡C−C≡N (a veces abreviada como NC4N), con enlaces covalentes triples y sencillos alternados. Puede ser visto como acetileno con los dos átomos de hidrógeno reemplazados por grupos cianuro.
| Dicianoacetileno | ||
|---|---|---|
|
| ||
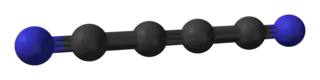 | ||
| Nombre IUPAC | ||
| but-2-ino dinitrilo | ||
| General | ||
| Otros nombres |
Subnitruro de carbono Dicianoetino 2-butinodinitrilo | |
| Fórmula semidesarrollada | N≡C−C≡C−C≡N | |
| Fórmula estructural | Estructura en Jmol | |
| Fórmula molecular | C4N2 | |
| Identificadores | ||
| Número CAS | 1071-98-3[1] | |
| ChemSpider | 13449 | |
| PubChem | 14068 | |
| Propiedades físicas | ||
| Masa molar | 76,06 g/mol | |
| Punto de fusión | 20,5 °C (294 K) | |
| Punto de ebullición | 76,5 °C (350 K) | |
| Termoquímica | ||
| ΔfH0gas | 533,46 kJ/mol | |
| ΔfH0líquido | 500,4 kJ/mol | |
| S0gas, 1 bar | 290,11 J·mol–1·K | |
| Compuestos relacionados | ||
| Compuestos relacionados |
Cianógeno Dióxido de tricarbono | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
A temperatura ambiente, el dicianoacetileno es un líquido claro. Debido a su altamente endotérmica entalpía de formación, puede explotar hasta polvo de carbono y gas nitrógeno, y se quema en oxígeno con una brillante llama blanquiazul a una temperatura de 5260 K (4990 °C),[2][3] la cual es la llama más caliente de cualquier sustancia química. Esta alta temperatura de llama es también resultado de la ausencia de hidrógeno y, por lo tanto, de agua como un producto de la combustión. Debido a su alto calor específico, el vapor de agua como producto de la combustión tiende a bajar la temperatura de la llama de los compuestos que contienen hidrógeno. La disociación endotérmica del agua a temperaturas altas sobre los 2000 °C también previene que las temperaturas de la llama se eleven sobre 3000-4000 °C.
Síntesis
El dicianoacetileno puede ser preparado haciendo pasar nitrógeno gaseoso sobre una muestra de grafito calentado a temperaturas entre 2673 y 3000 K.[4]
Reactivo en química orgánica
El dicianoacetileno es un poderoso dienófilo debido a que los grupos cianuro son electro-atractores, así que es un agente útil para una reacción de Diels-Alder con dienos no reactivos. Incluso se adiciona al compuesto aromático dureno (1,2,4,5-tetrametilbenzeno) para formar un biciclooctatrieno sustituido.[5] Solo los dienófilos más reactivos pueden atacar a tales compuestos aromáticos.
En el espacio exterior
El dicianoacetileno sólido ha sido detectado en la atmósfera de Titán mediante espectroscopia infrarroja.[6] Conforme las estaciones cambian en Titán, el compuesto se condensa y se evapora en un ciclo, lo cual permite a los científicos estudiar la meteorología del satélite.
A partir de 2006, la detección de dicianoacetileno en el medio interestelar ha sido imposible, debido a que su simetría implica que no tiene espectro rotacional de microondas. Sin embargo, moléculas asimétricas similares como el cianoacetileno han sido observadas, y por tanto se sospecha su presencia en esos ambientes.[7]
Referencias
- Número CAS
- Kirshenbaum, A. D.; Grosse, A. V. (1956). «The Combustion of Carbon Subnitride, C4N2, and a Chemical Method for the Production of Continuous Temperatures in the Range of 5000–6000°K». Journal of the American Chemical Society 78 (9): 2020. doi:10.1021/ja01590a075.
- Saggiomo, Andrew, J. (1957). «The Dinitriles of Acetylenedicarboxylic and Polyacetylenedicarboxylic Acids.1 I.2 Dicyanoacetylene and Dicyanodiacetylene». J. Org. Chem. 22 (10): 1171-1175. doi:10.1021/jo01361a009. Consultado el 1 de agosto de 2012.
- Ciganek, E.; Krespan, C. G. (1968). «Syntheses of Dicyanoacetylene». The Journal of Organic Chemistry 33 (2): 541-544. doi:10.1021/jo01266a014.
- Weis, C. D. (1963). «Reactions of Dicyanoacetylene». Journal of Organic Chemistry 28 (1): 74-78. doi:10.1021/jo01036a015.
- Samuelson, R. E.; Mayo, L. A.; Knuckles, M. A.; Khanna, R. J. (1977). «C4N2 Ice in Titan's North Polar Stratosphere». Planetary and Space Science 45 (8): 941-948. Bibcode:1997P&SS...45..941S. doi:10.1016/S0032-0633(97)00088-3.
- Kołos, R. (2002). «Exotic Isomers of Dicyanoacetylene: A Density Functional Theory and ab initio Study». Journal of Chemical Physics 117 (5): 2063-2067. Bibcode:2002JChPh.117.2063K. doi:10.1063/1.1489992.
Enlaces externos
- Esta obra contiene una traducción derivada de «Dicyanoacetylene» de Wikipedia en inglés, concretamente de esta versión, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.